工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺:将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为:2CuFeS2 + 2SiO2+5O2=2Cu+2FeSi03+4SO2该反应的氧化剂是_____。
(2)下列处理SO2的方法,不合理的是_____
| A.高空排放 |
| B.用纯碱溶液吸收制备亚硫酸钠 |
| C.用氨水吸收后,再经氧化制备硫酸铵 |
| D.用BaCl2溶液吸收制备BaSO3 |
(3)炉渣主要成分有FeO 、Fe2O3 、SiO2 ,Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有_____。
A过滤;B加过量NaOH溶液;C蒸发结晶;D灼烧;E加氧化剂
II.FeCl3溶液浸取工艺:其生产流程如下图所示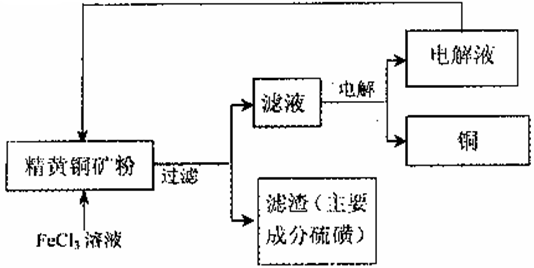
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为 _____________。
(5)该工艺流程中,可以循环利用的物质是_____(填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时溶液中Pb2+物质的量浓度为__mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
写出(1)乙炔的电子式:;(2)聚氯乙烯的结构 简式:
简式:
(3)苯和液溴反应生成溴苯的化学方程式:
将一定量的碳、氢、氧三种元素组成的有机物A的蒸气与3.2 g氧气混合点燃,再将生成的气体依次通过①盛有浓硫酸的洗气瓶;②灼热的氧化铜;③饱和石灰水(设每个装置中的反应物均过量)。经测定①中增重3.60g;②中减轻1.60g;③中增重8.80g。A的蒸气的密度为3.393g/L(折算成标准状况)。又测知A既能与碳酸钠溶液反应放出CO2气体,也能与金属钠反应有气体生成,但分别得到的气体的相同条件下体积不同。
(1)试求该有机物的分子式_______________,并写出可能的结构简式_______________。
(2)工业上用以下流程合成A: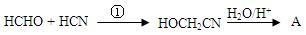
①的反应类型为_____________,画出HOCH2CN的结构式____________________。
(3)写出A在浓硫酸的作用下与醋酸作用,请写出这个方程式:
__________________________________________________________。
(16分) 甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列 路线合成分子式均为C9H10O2的有机化工产
路线合成分子式均为C9H10O2的有机化工产 品E和J。
品E和J。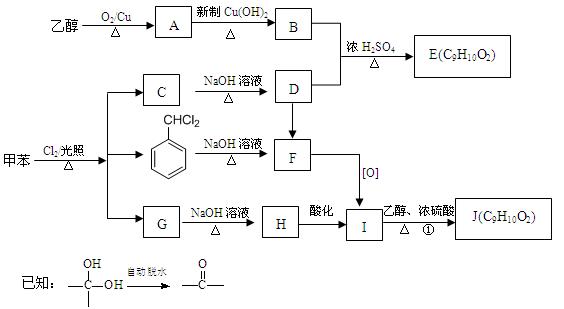
请回答:
(1)写出下列反应方程式
①A→B______________________________________________________。
②G→H ______________________________________________________。
③D→F______________________________________________________。
(2)①的反应类型为__________________;F的结构简式为___________________。
(3)E、J有多种同分异构体,写出符合下列条件的4种同分异构体结构简式。
要求:①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种。
①;②;③;④。
(9分) 现有A、B、C、D、E、F六种化合物,它们分别由下列五种原子团的两种不同的基团组成,这五种基团是-CH3,-C6H5,-OH,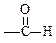 ,
,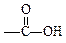 。
。
已知:(1) A是无色晶体,有特殊气味,在空气中易氧化成粉红色;
(2) B、C能发生银镜反应,C的分子量大于B;
(3) D的水溶液与少量氢氧化钠溶液反应,生成-1价的阴离子;与过量氢氧化钠溶液反应,生成-2价阴离子。D可以和A的钠盐反应生成A;
(4) E可以由B氧化制取;
(5) F能氧化成饱和一元醛。
根据上述条件,推断其结构简式分别为:
ABC
DEF。
上述A、D、E的酸性由强到弱的顺序是(用化学式表示)。
(10分) 根据下列合成流程图推断: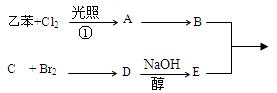
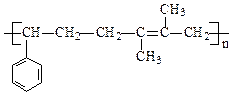
(1)写出下列物质结构简式:
B:C:E:
(2)判断①反应类型:。
(3)写出D→E的反应方程式:。