(9分) 现有A、B、C、D、E、F六种化合物,它们分别由下列五种原子团的两种不同的基团组成,这五种基团是-CH3,-C6H5,-OH,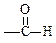 ,
,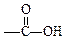 。
。
已知:(1) A是无色晶体,有特殊气味,在空气中易氧化成粉红色;
(2) B、C能发生银镜反应,C的分子量大于B;
(3) D的水溶液与少量氢氧化钠溶液反应,生成-1价的阴离子;与过量氢氧化钠溶液反应,生成-2价阴离子。D可以和A的钠盐反应生成A;
(4) E可以由B氧化制取;
(5) F能氧化成饱和一元醛。
根据上述条件,推断其结构简式分别为:
A B C
D E F 。
上述A、D、E的酸性由强到弱的顺序是 (用化学式表示)。
新制的氯水呈淡黄绿色,说明氯水中有____________分子存在;向氯水中滴入几滴AgNO3溶液,立即生成白色沉淀,说明氯水中有_____________存在;蓝色石蕊试纸遇到氯水后,首先变红,但很快又褪色,这是因为__________;氯水经光照后,淡黄绿色逐渐消失,并放出无色的气体,该反应的化学方程式是__________。
某化合物的相对分子质量为 ,在
,在 ℃时
℃时 mL该化合物的饱和溶液为
mL该化合物的饱和溶液为 g,将其蒸干后得到固体
g,将其蒸干后得到固体 g。该化合物在
g。该化合物在 ℃时的溶解度为_______________g,该饱和溶液中溶质的物质的量浓度为_____________ mol·L-1。
℃时的溶解度为_______________g,该饱和溶液中溶质的物质的量浓度为_____________ mol·L-1。
在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9 kg氧气,呼出10kg二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。有的科学家提出“金属过氧化物处理系统”即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式是①________,②___________;将处理后的气体充入座舱时,应注意采取的一项措施是____________。
(12分)作为国家正在实施的“西气东输”工程终点站,上海将逐渐改变以煤、石油为主的能源结构,这对解决城市环境污染意义重大。目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为居民燃料,管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4,它们的燃烧反应为2CO+O2 2CO2 2H2+O2
2CO2 2H2+O2 2H2O CH4+2O2
2H2O CH4+2O2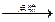 CO2+2H2O
CO2+2H2O
(1)根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是____________________________,因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是______________________进风口(填“增大”或“减小”),如不作改进可能产生的后果是____________________________________。
(2)管道煤气含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
| 乙烷 |
丙烷 |
丁烷 |
|
| 熔点(℃) |
-183.3 |
-189.7 |
-138.4 |
| 沸点(℃) |
-88.6 |
-42.1 |
-0.5 |
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是__________________。
(2分)下列过程,吸收热量的是_____________。
①Ba(OH)2·8H2O晶体和氯化铵混合搅拌 ②盐酸和氢氧化钠溶液混合 ③铝片放入稀硫酸中 ④断开1 mol H—H键