A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C常温下能形成两种液态化合物A2C和A2C2,E元素的周期数与主族序数相等。
请用化学用语回答下列问题:
(1)E元素在周期表中的位置为____________,请写出E最高价氧化物对应水化物的电离方程式:_________________________________。
(2)C、D、E三种元素对应简单离子半径从大到小的顺序为_____>_____>_____;
由A、B、C三种元素组成的18电子微粒的分子式为______________________。
(3)用电子式表示BC2的形成过程:_________________________________。
(4)原子序数比C小1的元素F,也能与A形成18电子的分子,已知1 mol该分子在一定条件下可以还原4 mol氧化铜,同时生成一种无污染的气体单质和红色固体还有水。请写出化学方程式_____________。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式:___________。
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA, DA能与水反应放出氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是_________L。
已知下表为25℃时某些弱酸的电离平衡常数;下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。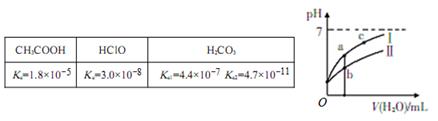
(1)图像中,曲线Ⅰ表示的酸是____(填化学式);
(2)a、b、c三点中,水的电离程度由大到小的顺序是___________(用编号表示)。
(3)25℃时,NaClO溶液的水解平衡常数Kh=_______________。
(4)25℃时,NaHCO3溶液存在水解平衡,写出其水解的离子方程式
(5)0.1mol/L Na2CO3溶液中c(OH-)—c(H+)=_________(用含c(HCO3-)、c(H2CO3)的关系式表示)。
(1)将0.2mol/L HA 溶液与 0.1mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A−),则(用“>”、“<”或“=”填写下列空白):①混合溶液中c(A−)______c(HA);②混合溶液中c(HA)+c(A−)______0.1mol⋅L−1;
(2)常温时,取0.1mol•L-1 HX溶液与0.1mol•L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
①混合溶液中由水电离出的c(OH-)与0.1mol•L-1 NaOH溶液中由水电离出的c(OH-)之比为______.
②已知NH4X溶液是中性,又知将HX溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(选填“>”、“<”或“=”).
氨气是一种重要工业原料,在工农业生产中具有重要的应用.
(1)已知:N2(g)+O2(g)═2NO(g);△H=+180.5kJ•mol-1
4NH3(g)+5O2(g)═4NO(g)+6H2O(g);△H=-905kJ•mol-1
2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol-1
则N2(g)+3H2(g)═2NH3(g);△H=______
(2)工业合成氨气的反应为N2(g)+3H2(g)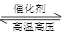 2NH3(g);在一定温度下,将一定量的N2和H2通入到初始体积为1L的密闭容器中达到平衡后,单独改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是______.(填序号)
2NH3(g);在一定温度下,将一定量的N2和H2通入到初始体积为1L的密闭容器中达到平衡后,单独改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是______.(填序号)
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)将相同体积、pH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序为______.
(4)氢气是合成氨的原料之一,下图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程。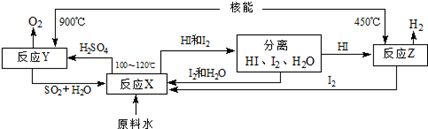
反应X的化学方程式为SO2+I2+2H2O=2HI+H2SO4该流程中循环使用的原料除了SO2外,还有 。从理论上讲,该流程中,1mol原料水制得 molH2。
(1)已知在氨水中存在下列平衡:
①向氨水中加入NaOH固体时,平衡向 (填“正反应”“逆反应”或“不”)移动,OH-的浓度 (填“减小”“增大”或“不变”)
②向氨水中加入浓盐酸,平衡向 (填“正反应”“逆反应”或“不”)移动,此时溶液中浓度增大的离子有NH4+(Cl-除外)和
(2)已知某溶液中只存在OH−、H+、NH4+、Cl−四种离子,某同学推测其离子浓度大小顺序有以下几种:
A.c(Cl−)>c(NH4+)>c(H+)>c(OH−) B.c(Cl−)>c(NH4+)>c(OH−)>c(H+)
C.c(NH4+)>c(Cl−)>c(OH−)>c(H+) D.c(Cl−)>c(H+)>c(NH4+)>c(OH−)
①上述关系一定不正确的是______(填序号).
②若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为______(填序号).
③若四种离子浓度关系有c(NH4+)=c(Cl−),则该溶液显______(填“酸性”、“碱性”或“中性”).
(3)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。
①则:B是______溶液,C是______.
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示.则pHb+pHc= (填某个数)
答案:(1)①逆反应增大 ②正反应 H+(2)促进不变
(3)①B ②A ③中性(4)①CH3COONa盐酸 ②14
亚磷酸(H3PO3)与足量NaOH溶液反应生成Na2HPO3
(1) 亚磷酸是________元酸。
(2)PCl3水解可制取亚磷酸,反应的化学方程式是______________;
(3)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3-
H++H2PO3-
①某温度下,0.10mol•L-1的 H3PO3溶液 pH=1.6,即溶液中 c(H+)=2.5×10-2mol•L-1.求该温度下上述电离平衡的平衡常数K= ________;(只考虑H3PO3的第一步电离,结果保留两位有效数字)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH ______7 (填“>”、“=”或“<”);
(4)亚磷酸具有强还原性,可使碘水褪色.该反应的化学方程式为______________。