(14分)A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、
D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶
液呈碱性,E与C的最外层电子数相同。
(1)画出D的原子结构示意图 ,E元素在周期表中的位置是 。
(2)A与C形成原子个数比为1:1的化合物甲,其中含有化学键类型为 。
(3)D与C按原子个数比为1:1形成化合物的电子式是 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是 (填具体的化学式)。
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与 C形成的化合物甲反应的离子方程式 。
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式: ;放电时溶液中H+移向 (填“正”或“负”)极。
(7) E(s)+O2(g) EO2(g) △H1 E(g)+O2(g) EO2(g) △H2,则△Hl △H2(填“>”或“<”或“=”)。
 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题: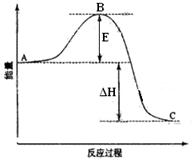
(1) 图中E的大小对该反应的反应热(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H(填“变大”、“变小”或“不变”
图中E的大小对该反应的反应热(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H(填“变大”、“变小”或“不变” )。
)。 (2)图中△H=KJ·mol-1。
(2)图中△H=KJ·mol-1。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)该反应的热化学方程式为
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
(1)电解质溶液为稀H2SO4时,灯泡_______(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的电极反应方程式为:________________________;
Al电极上发生的电极反应方程式为:_______________________。
b.若灯泡不亮,其理由为:_________________________________。
(2)电解质溶液为NaOH溶液时,灯泡_______(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的电极反应方程式为:_________________________;
Al电极上发生的电极反应方程式为:___________ ______________。
______________。
b.若灯泡不亮,其理由为:_____________ ___________。
___________。
A、B、C、D、E、F六种物质均是由短周期元素组成的中学常见的化学物质。它们之间的转化关系如下图(一定条 件下)。A、C、E都为氢化物,三者中C的相对分子质量最小;A、C具有相同的电子数;D、E、F都为氧化物,且D、F皆为有毒气体。则:
件下)。A、C、E都为氢化物,三者中C的相对分子质量最小;A、C具有相同的电子数;D、E、F都为氧化物,且D、F皆为有毒气体。则: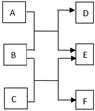
(1)A:______ C:_______ D:_______ E:______ F:______ (填化学式)
(2)A、C、E三者沸点从高到低的顺序为____________________(填化学式);
(3)A、C、E中稳定性最差的是____________________(填化学式);
下列共有十四种化学符号: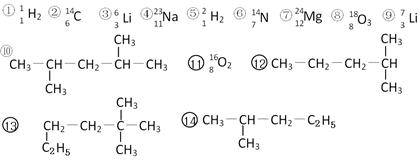
其中:
(1)表示核素的符号共有种;
(2)互为同位素的是(填序号,以下相同);
(3)中子数相等,但质子数不相等的是;
(4)有机物中是同一种物质的是;
(5)⑩的一氯代物的同分异构体数目:;⒀的一氯代物的同分异构体数目:。