甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如下图。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.c ( H2 )减少 | B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 | D.重新平衡c ( H2 )/ c (CH3OH )减小 |
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
① 写出阳极电极反应式 。
② 写出除去甲醇的离子方程式 。
【化学------必修】(15分)
Ⅰ、在稀硫酸酸化的含6 mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图。
请回答下列问题:
(1)b点时,对应含碘物质的化学式为。
(2)b→c过程中,仅有一种元素发生化合价变化,写出该反应的化学方程式并标出电子转移方向与数目。
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为。
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为。
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中的可能观察到的现象为。
Ⅱ、(6)氨水和NH4Cl等物质的量混合配制成的稀溶液,c(Cl-)<c(NH4+),下列说法错误的是( )
A氨水的电离作用大于NH4Cl的水解作用 B氨水的电离作用小于NH4Cl的水解作用
C氨水的存在抑制了NH4Cl的水解 DNH4Cl的存在抑制了氨水的电离
E、 c(H+)>c(OH-) F、 c(NH3•H2O)>c(NH4+)
G、c(NH3•H2O)+c(NH4+)=2c(Cl-) H、c(NH3•H2O)+c(OH-)=c(Cl-)+c(H+)
【化学------选修物质结构与性质】
五种短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲和丙同族,乙离子和丙离子具有相同的电子层结构。甲和乙、丁、戊均能形成共价型化合物。甲和乙形成的化合物在水中呈碱性,单质丁在单质戊中可燃烧产生白色烟雾。回答下列问题:
(1)五种元素中,原子半径最大的是,非金属性最强的是;(填元素符号)
(2)由甲和乙、丁、戊所形成的共价型化合物中,热稳定性最差的是;(用化学式表示);
(3)甲和乙形成的化合物的中心原子的杂化类型为;甲和乙形成的化合物可与甲和戊形成的化合物反应,其产物中存在的化学键类型为;
(4)除乙外,上述元素的电负性从大到小依次为;(填元素符号);
(5)单质戊与水反应的离子方程式为;
(6) 一定条件下1.86g单质丁与2.912L单质戊(标准状况)反应, 则产物为,(用化学式表示)其物质的量之比为。
【化学——选修化学与技术】
明矾石经处理后得到明矾[ KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:

焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题: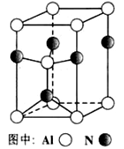 (1)在焙烧明矾的反应中,还原剂是;
(1)在焙烧明矾的反应中,还原剂是;
(2)从水浸后的滤液中得到K2SO4晶体的方法是;
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是;
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g)△H1= 一197 kJ/mol;
2SO3(g)△H1= 一197 kJ/mol;
2H2O (g)=2H2O(1)△H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是;
(6)焙烧948吨明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸吨。
下图中,B、D、E、F、G是氧化物,F和K都是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质,其水溶液与D均具有漂白性。O是白色沉淀,在空气中很容易转化为N,且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品,其工业制备过程包括反应⑤和⑥(图中部分反应物和生成物没有列出)。请按要求回答: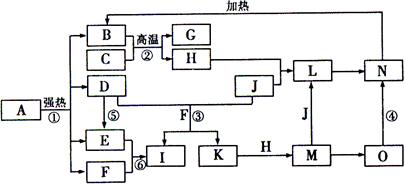
(1)写出L的化学式:。
(2)写出:反应③的离子方程式;
反应④的化学方程式;
反应④的现象是。
(3)反应②在工业生产上的用途是。
(4)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1:1:1:14,则反应①的化学方程式为。
Ⅰ.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H
2Fe(s)+3CO2(g)△H
(1)已知:①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g) △H1=+489.0 KJ·mol-1
②C(石墨,s)+CO2(g)=2CO(g) △H2=+172.5KJ·mol-1;则△H=kJ•mol-1。
(2)高炉炼铁反应的平衡常数,温度升高后,K值(填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 |
CO |
Fe |
CO2 |
|
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
2.0 |
1.0 |
1.0 |
①甲容器中CO的平衡转化率为。
②下列说法正确的是(填字母)。
A.当容器内气体密度恒定,表明反应达到平衡状态
B.甲容器中CO的平衡时的速率小于乙容器中CO平衡时的速率
C.甲、乙容器中,CO的平衡浓度之比为3:2
D.增加Fe2O3的量可以提高CO的转化率
Ⅱ.(1)汽车尾气是城市空气污染的一个重要因素,一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,在高温熔融状态下能传导O2-(过程中无气体产生),则负极的反应式为。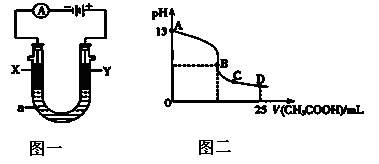
(2)以上述电池为电源,通过导线连接成图一电解池。
①若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式________。
②若X、Y分别为铜、银,a为1L 0.2mol/L AgNO3溶液,写出Y电极反应式__________。
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
①结合图二计算,上述电解过程中消耗一氧化碳的质量为____________g。
②若图二的B点pH=7,则滴定终点在区间(填“AB”、“BC”或“CD”)。