H是一种新型香料的主要成分之一,其结构中含有三个六元环。H的合成路线如下(部分产物和部分反应条件略去):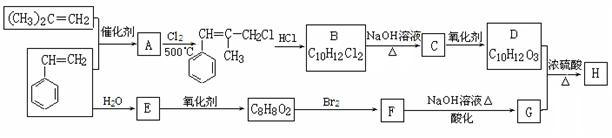
已知:①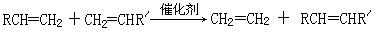
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
③D和G是同系物
请回答下列问题:
(1)用系统命名法命名(CH3)2C=CH2: 。
(2)A→B反应过程中涉及的反应类型有 。
(3)写出D分子中含有的官能团名称: 。
(4)写出生成E的化学方程式: 。
(5)写出H的结构简式: 。
(6)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有 种(不包括立体异构),其中核磁共振氢谱为5组峰的为 (写结构简式)。
0.80g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200℃时固体物质的化学式______________(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_________,其存在的最高温度是_____________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为________________;
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):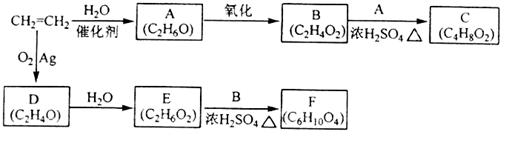
请回答下列问题:
(1)A的化学名称是_______;
(2)B和A反应生成C的化学方程式为___________,该反应的类型为_____________;
(3)D的结构简式为___________;
(4)F的结构简式为_____________;
(5)D的同分异构体的结构简式为___________。
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题:
(1)元素Z位于周期表中的位置;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________;
(4)Y的最高价氧化物的化学式为________________;
(5)W和Y形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。
已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平): Cu + 2H2SO4(浓) ="=" CuSO4 + A ↑ + 2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______(填字母代号)。
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中_______(填写化学式)失去电子。
(2)学习了分类法后,甲同学把下列物质分为一类:CuSO4溶液、CuSO4·5H2O、Cu(OH)2、液态O2。你认为甲同学分类的标准是_______________________。
根据物质之间的反应关系判断,下列反应能生成CuSO4的是_______(用字母代号填写)。
a.金属+酸 b.金属氧化物+酸 c.碱+酸 d.盐+酸
(3)足量的铜片与含溶质1.8 mol的浓H2SO4充分反应,如果该反应过程中转移了 0.2 mol电子,生成的CuSO4的质量为____________克,生成的A气体在标准状况下体积为______升(假设气体全部逸出)。
(4)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。请写出此过程发生的反应的离子方程式:_____________ _____;__________________。计算:反应后所得沉淀的质量为_____克(保留到0.1g)。
_____;__________________。计算:反应后所得沉淀的质量为_____克(保留到0.1g)。
电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下: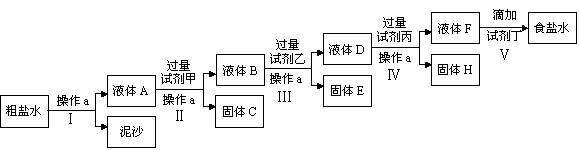 请回答以下问题:
请回答以下问题:
(1)操作a的名称是_______,所用玻璃仪器有_____________;
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)___溶液;
(3)写出固体H所含物质的化学式_____________;
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式
_______________________;_______________________。