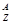 X表示原子:
X表示原子:
(1)中性原子的中子数N=______。
(2)AXn+共有x个电子,则该阳离子的中子数N=______。
(3)AXn-共有x个电子,则该阴离子的中子数N=______。
(4)12C16O2分子中的中子数N=________。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为________。
MnO2是一种重要的无机功能材料。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯净MnO2的实验,其流程如下:
请回答下列问题:
(1)第①步加稀硫酸时,粗MnO2样品中的MnO和MnCO3转化为(填化学式)_______________。
(2)第①步反应中的硫酸能否用盐酸代替?____________(填“能”或“否”),理由是____________。
(3)第②步发生反应的离子方程式为:___________________________。
(4)取17.4gMnO2与200g36.5%的浓盐酸(足量)反应,将反应后剩余的溶液用水稀释至500mL,计算稀释后溶液中Cl-的物质的量浓度(写出计算过程)。
下面是中学化学中常用的玻璃仪器组成的实验装置图(根据需要可在广口瓶中加入液体)。
下面是中学化学中常用的玻璃仪器组成的实验装置图(根据需要可在广口瓶中加入液体或在干燥管中放入固体)。
请回答下列问题:
(1)用装置A收集NH3气体,气体应从_________________(填“①”或“②”)处通入。
(2)若用装置B做二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶能否起到防倒吸作用(填“能”或“不能”)______________________。
(3)用C来收集NO2气体,最终得不到NO2,其发生反应的化学方程式为:___________________。
[理论综合]运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O。则电解质溶液为KOH,则负极反应式为______________________________。
(2)25℃时.将amol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时.则反应的情况可能为__________。
a.盐酸不足.氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时.用含含a的代数式表示NH3•H2O的电离常数Kb=____________。
(3)向BaCl2溶液中通CO2不会出现沉淀,请根据溶液里存在的平衡原理解释其原因___________,某同学根据相同的理由认为向BaCl2溶液中通入SO2也不会出现沉淀,但在实验验证中发现了异常情况,将SO2通入BaCl2溶液中开始并无沉淀,放置一段时间出现了白色沉淀,则产生该沉淀的离子反应方程式为___________。
(4)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l) H4SiO4(aq) △H
H4SiO4(aq) △H
①写出该反应的化学平衡常数K的表达式:________________。
②通常情况下,改变压强对气体会产生较大影响,对固体和液体影响很小,实际上,在地球的深处,由于压强很大,固体、液体受到的压强影响不能忽略。一定温度下,在10000m以下的地球深处,上述反应进行的方向是_________________________(填“正方向”、“不移动”或“逆方向”)。请根据平衡常数表达式解释其原因_____________________________。
[化学与技术]由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。
在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。
冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①在一定条件下,在一个容积固定为2L的密闭容器中充入0.8molNO和1.20molCO,开始反应至3min时测得CO的转化率为20%,则用N2表示的平均反应速率为V(N2)=____________________。
②对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=________________。
③该反应在低温下能自发进行,该反应的△H_________0,(选填“>”、“=”或“<”)
④在某一绝热,恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知t2—t1=t3—t2)。
则下列说法不正确的是__________。(填编号)
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率t1—t2=t2—t3
(2)使用甲醇汽油可能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)⇌CH3OH(g),到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通人3mol CO,此时v(正)__________ v(逆)(选填‘‘>”、“<’’或“=”),判断的理由__________________。
(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定条件下,该反应中CO的平衡转化率随温度、投料比 的变化曲线如图:
的变化曲线如图:
①a、b、c按从大到小的顺序排序为___________。
②某温度下,将2.0mol CO(g)和4.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如上图所示,关于温度和压强的关系判断正确的是___________;
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___________:
A.正反应速率先增大后减小
B.逆反应速率先增大后减小
C.化学平衡常数K值增大
D.反应物的体积百分含量增大
E.混合气体的密度减小
F.氢气的转化率减小