有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质,分别设计了如图所示的原电池,请完成下列问题: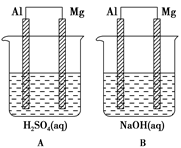
(1)①负极材料:
A池________,B池________。
②电极反应式:
A池:正极:________,负极:________
B池:正极:________,负极:________
(2)B池总反应的离子方程式为_________________________________。
下表为部分短周期元素化合价及相应氢化物沸点的数据:
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 氢化物的沸点(℃) |
-60.7 |
-33.4 |
-111.5 |
100 |
-87.7 |
19.54 |
-84.9 |
-161.5 |
| 最高化合价 |
+6 |
+5 |
+4 |
+5 |
+7 |
+4 |
||
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是(用表中元素编号填写)。
(2)写出H的最高价氧化物的电子式:;
比较A、D、G三种简单阴离子的半径大小:r()>r()>r() (均用实际的元素符号表示)。
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________________。
a.MnO2b.FeCl3 c.Na2SO3d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是:。
(本题11分) 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是__________________。
(2)B→C的反应类型是________。
(3)E的结构简式是__________________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:__________________。
(5)下列关于G的说法正确的是________。
a.能与溴单质反应
b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应
d.分子式是C9H6O3
(本题10分)
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OH浓硫酸170 ℃CH2===CH2+H2O),将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的 杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应。
杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应。
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是________(填编号)。
| A.使溴水褪色的反应,未必是加成反应 |
| B.使溴水褪色的反应,就是加成反应 |
| C.使溴水褪色的气体,未必是乙烯 |
| D.使溴水褪色的气体,就是乙烯 |
(2)乙同学推测此乙烯中可能含有的一种杂质气体是____________,它与溴水发生反应的化学方程式是___________________,在验证过程中必须全部除去。
(3)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取哪些方法?
(本题16分)
(1)某化合物结构简式如图,请根据所示的化合物回答问题:
该化合物中,官能团①的名称是________;官能团⑦的名称是________;该化合物是由________个氨基酸分子脱水形成的;写出该化合物水解生成的氨基酸的结构简式(任写一种):________;并写出此氨基酸与氢氧化钠溶液反应的化学方程式:_________________
(2)某有机物含有C、N、H、O四种元素,下图为该有机物的球棍模型。
①该有机物的化学式______________________________。
结构简式_______________________________________________ _______。
_______。
②该有机物可能发生的化学反应有(填编号)________。
a.水解 b.加聚c.取代 d.消去e.酯化
③该有机物发生水解反应的化学方程式__________________________________。
(本题12分)
在有机物分子中,常把连有四个不同原子或原子团的碳原子称为“手性碳原子”,可用“C*”标记。如:含有生命活性的物质不少都含有“手性碳原子”。具有某些光学活性的有机分子中必含有“手性碳原子”。某新合成的化合物A经测定具有光学活性,其结构简式为: 若通过适当的反应使A失去光学活性,请回答下列问题:
若通过适当的反应使A失去光学活性,请回答下列问题:
(1)保持A分子中碳原子数不变(两种方法):
①有机反应类型:________反应,对应无光学活性有机物的结构简式:________________。
②有机反应类型:________反应,对应无光学活性有机物的结构简式:________________。
(2)使A的分子中碳原子数增加2:
有机反应类型:________反应,对应无光学活性有机物的结构简式:________________。
(3)使A的分子中碳原子数减少2:
有机反应类型:________反应,对应无光学活性有机物的结构简式:________________。