在密闭容器中进行反应:X2(g)+3Y2(g)  2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
| A.c(Z)=0.5 mol·L-1 | B.c(Y2)=0.5 mol·L-1 |
| C.c(X2)=0.2 mol·L-1 | D.c(Y2)=0.6 mol·L-1 |
下列实验操作或结论表述正确的是()
| A.纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些 |
| B.判断CuO和MnO2对H2O2分解的催化效率,可通过观察比较H2O2溶液析出气泡的快慢程度,或测定单位时间内H2O2分解产生氧气的体积 |
| C.食醋总酸含量测定实验中,锥形瓶水洗后未用待测液润洗,实验结束时碱式滴定管尖嘴部位有气泡,则测定的醋酸含量偏高 |
| D.将硫酸亚铁和硫酸铵的混合溶液加热浓缩,冷却结晶后可析出摩尔盐粗产品,再用酒精洗去晶体表面的水分,加热烘干后称重,计算产率 |
下列说法正确的是()
| A.根据Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=1.12×10-12,可以推知AgCl的溶解度比Ag2CrO4的溶解度大 |
B.0.1mol·L-1的ZnCl2溶液中通入足量硫化氢气体,最终得不到ZnS沉淀。是因为溶液 中c(Zn2+)·c(S2-)<Ksp(ZnS) 中c(Zn2+)·c(S2-)<Ksp(ZnS) |
| C.向硫酸钡沉淀中加入碳酸钠溶液,沉淀发生转化,据此可推知碳酸钡的Ksp比硫酸钡的小 |
| D.AgCl在10mL 0.01mol·L-1的KCl溶液中比在20mL0.05mol·L-1的AgNO3溶液中溶解的质量少 |
对于可逆反应N2(g)+3H2(g)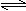 2NH3(g);△H<0,下列研究目的和示意图相符的是()
2NH3(g);△H<0,下列研究目的和示意图相符的是()
| A |
B |
C |
D |
|
| 研究 目的 |
压强对反应的影响(P2>P1) |
温度对反应的影响 |
平衡体系增加N2的浓度对反应的影响 |
催化剂对反应的影响 |
| 图示 |
 |
 |
 |
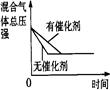 |
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为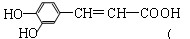 下列有关咖啡酸的说法中,不正确的是()
下列有关咖啡酸的说法中,不正确的是()
| A.咖啡酸分子中的所有碳原子可能共平面 |
| B.咖啡酸可以发生还原、酯化、加聚、显色等反应 |
| C.1 mol咖啡酸可与4 mol Br2发生反应 |
| D.1 mol咖啡酸与NaOH溶液反应最多消耗1 mol的NaOH |
在盛有1mL1mol·L-1AlCl3溶液的试管中加入2 mL10%的NH4F溶液,再加入1mL3mol·L-1氨水,没有生成白色沉淀,其原因是()
| A.溶液的碱性不够强 | B.Al3+不与氨水反应 |
| C.生成的Al(OH)3溶解了 | D.Al3+几乎都与F-结合生成了新的物质 |