反应C(s)+H2O(g)  CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )。
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )。
①增加C的量 ②将容器的体积减小一半 ③保持体积不变,充入氮气使体系的压强增大 ④保持压强不变,充入氮气使体系的体积增大
| A.①② | B.②③ | C.①③ | D.③④ |
已知:⑴H2(g)+1/2 O2(g)=H2O(g);△H =" a" kJ·mol-1Ⅴ
⑵ 2H2(g)+O2(g)=H2O(g);△H ="" b kJ·mol-1
⑶H2(g)+1/2 O2(g)=H2O(l);△H ="" ckJ·mol-1
⑷2H2(g)+ O2(g)=H2O(l);△H =" d" kJ·mol-1
下列关系正确的是()
| A.a <c <0 | B.b >d >0 |
| C.2a=b <0 | D.2c=d >0 |
在相同温度和压强下,将32g硫分别在纯氧中和空气中完全燃烧,令前者放出的热量为Q1,后者放出的热量为Q2,则关于Q1和Q2的相对大小正确的判断是()
| A.Q1=Q2 | B.Q1>Q2 |
| C.Q1<Q2 | D.无法判断 |
已知A(g)+B(g)=C(g);△H1,D(g)+B(g)=E(g);△H2,且△H1<△H2,若A和D的混合气体1mol 完全与B反应,反应热为△H3,则A和D的物质的量之比为()
A.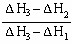 |
B.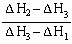 |
C.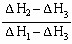 |
D. |
在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)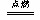 2CO2(g);△H = -566kJ·mol-1
2CO2(g);△H = -566kJ·mol-1
CH4(g)+ 2O2(g)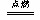 CO2(g)+ 2H2O(l);△H = -890kJ·mol-1
CO2(g)+ 2H2O(l);△H = -890kJ·mol-1
由1molCO和3molCH4组成的混合气体在上述条件下完全燃烧时,释放的热量为()
| A.2912 kJ | B.2953 kJ | C.3236 kJ | D.3867 kJ |
已知1mol白磷变成1mol红磷放出18.39kJ的热量。下列两个方程式:
4P(白磷,s)+5O2(g)=2P2O5(s);△H1
4P(红磷,s)+5O2(g)=2P2O5(s);△H2
则△H1和△H2的关系正确的是()
| A.△H1 =△H2 | B.△H1>△H2 |
| C.△H1<△H2 | D.不能确定 |