锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
| Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是_________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:______________________________________。
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称___________,洗涤所得Li2CO3沉淀要使用______________ (选填“热水”或“冷水”),你选择的理由是________________。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是:__________________________。
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如图:回答下列问题: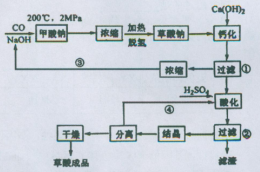
(1)CO和NaOH在一定条件下合成甲酸钠,甲酸钠加热脱氢的化学反应方程式分别为:____、____。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是,滤渣是____;过滤操作②的滤液是和,滤渣是____。
(3)工艺过程中③和④的目的是____。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是___。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMn04溶液滴定,至浅粉红色不消褪,消耗KMn04溶液15.00 mL,反应的离子方程式为____;
列式计算该成品的纯度。
某研究性学习小组在网上搜集到信息:钾、钙、钠、镁等活泼金属能在CO2气体中燃烧。他们对钠在CO2气体中燃烧进行了下列实验:
| 操作过程 |
实验现象 |
| 将干燥的玻璃燃烧匙中燃烧的钠迅速 伸入到盛有装满CO2的集气瓶中 |
钠在盛有CO2的集气瓶中继续燃烧 |
| 反应后冷却 |
集气瓶底附着黑色颗粒,瓶壁上附着有白色 物质 |
(1)要熄灭燃烧的钠,可以选用的物质是____(填字母)
a.水 b.泡沫灭火剂 c.干沙土 d.二氧化碳
(2)该小组同学对瓶壁上的白色物质的成分进行讨论并提出假设
I.白色物质是Na2O;
II.白色物质是Na2CO3;
III.白色物质还可能是
(3)
| 实验步骤 |
实验现象 |
| ①取少量白色物质于试管中,加入适量水,振荡,样品全 部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
①通过对上述实验的分析,你认为上述三个假设中,____成立。
②写出该反应的方程式。
双安妥明是一种降血脂药物,主要用于降低血液中胆固醇浓度,安全,副作用小,其结构简式为: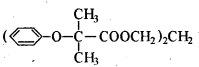
已知: I.
II.
双安妥明的合成路线如下: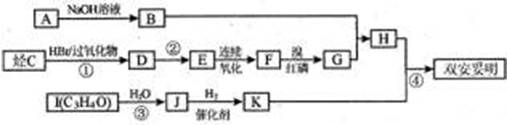
已知:C的分子式为C4H8,且有支链;
I能发生银镜反应且1molI能与2mol氢气发生加反应;
K的结构具有对称性.
试回答下列问题:
(1)写出C与氯气在催化剂条件下反应后产物的名称:;J的结构简式:
(2)反应②的条件是反应③的类型是
(3)写出反应④的化学方程式为:
(4)与F互为同分异构体,且属于酯类的有机物有种,并写出其中能发生银镜反应的有机物的结构简式:、。
碳及其化合物有广泛的用途。
(1)在电化学中,常用碳作电极。在碱性锌锰干电池中,碳棒作极。
(2)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)=CO(g)+H2(g);△H=+131.3kJ•mol-1,则要制备标准状况下22.4升水煤气,转移的电子的物质的量为,需要吸收的热量为kJ。
(3)工业上把水煤气中的混合气体经过处理后,获得的较纯H2用于合成氨:
N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ•mol-1。下图1是在两种不同实验条件下模拟化工生产进行实验所测得N2随时间变化示意图。
2NH3(g);△H=-92.4kJ•mol-1。下图1是在两种不同实验条件下模拟化工生产进行实验所测得N2随时间变化示意图。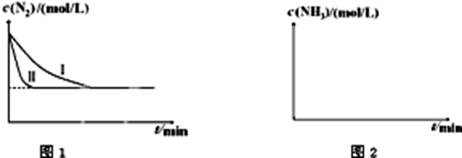
①与实验Ⅰ比较,实验Ⅱ改变的条件为:。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
(4)Na2CO3可在降低温室气体排放中用作CO2的捕捉剂。1L0.2mol/L Na2CO3溶液吸收标准状况下2.24LCO2后,溶液中各离子浓度由大到小的顺序为。
(16分) 以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。
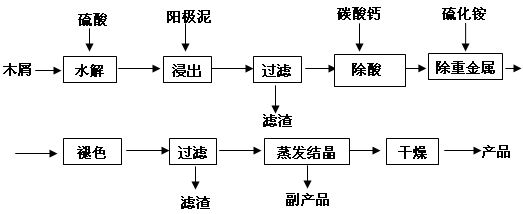
(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为。
(2)写出木屑水解反应的化学方程式:。配平浸出步骤反应方程式C6H12O6 + MnO2 + H2SO4→ MnSO4 + CO2 + H2O
(3)若取消除酸操作步骤,将会产生气体(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式;
(5)取一定量的阳极泥进行实验分析,得到如下图像。硫酸的最合适用量为mL,若再增加硫酸的用量,将会导致(填化学式)的消耗量增大。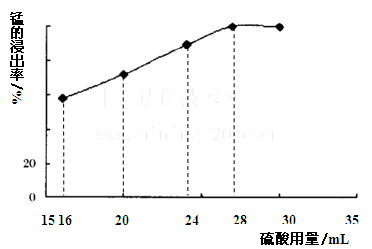
(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于L。(假设阳极泥中的其它成分不参与反应)