由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题。
(1)该配位化合物X的化学式为 。
(2)元素B、C、D的第一电离能的由小到大排列顺序为 。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________ 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如下图:其中碳原子的杂化方式有____ 。碳铂中含有的作用力有 (填字母)。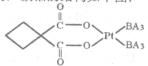
A.共价键
B.配位键
C.金属键
D.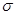 键
键
E.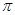 键
键
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式 。单质E的晶胞如图所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为p= g/cm3。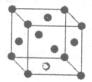
合成氨工业中,原料气(N2、H2、混有少量CO、NH3)在进入合成塔之前,常用醋酸二氨合铜(Ⅰ)溶液来吸收CO,其反应为CH3COO[Cu(NH3)2]+CO+NH3
CH3COO[Cu(NH3)3]·CO(正反应为放热反应)。
(1)必须除去CO的原因是___________________________。
(2)醋酸二氨合铜(Ⅰ)溶液吸收原料气中CO的适宜条件是______________________。
(3)吸收CO后的醋酸铜(Ⅰ)氨溶液经适当处理又可再生,恢复其吸收CO的能力而循环使用,其再生的条件是______________________________。
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
| A.矿石加入沸腾炉之前先粉碎 |
| B.使用V2O5作催化剂 |
| C.转化器中使用适宜的温度 |
| D.净化后的炉气中要有过量的空气 |
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+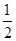 O2(g)
O2(g) 2SO3(g)ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
2SO3(g)ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸收塔中反应物之间是怎样对流的。______________________________。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
________________________________________________________________________
工业接触法制硫酸的简单流程图如下: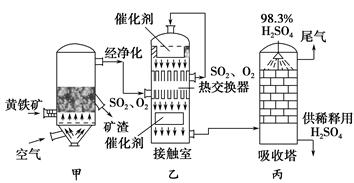
(1)写出装置甲的名称________。要使黄铁矿充分和迅速地燃烧,工业上常采取的措施为__________________________________。
(2)接触室中二氧化硫与氧气的反应采用________(填“常压”或“高压”),原因是________________________________。
(3)刚通入接触室中的SO2和O2在热交换器的管道________(填“里”或“外”)流动,在催化剂表面接触反应的SO2和O2在热交换器的管道________(填“里”或“外”)流动,这样两种流体通过管壁进行热交换。
(4)在吸收塔中为什么用98.3%的浓硫酸而不是用水吸收三氧化硫?
______________________________________________________________。
(5)工业接触法制硫酸的过程中,有两个操作过程采用了逆流的原理,它们分别是_____________________________________
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:__________________、__________________。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是______________;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为______________。
石膏也可用于工业生产二氧化硫,进而生产硫酸。天然石膏的化学式为CaSO4·2H2O。将天然石膏脱水后,第2步化学反应就可制得二氧化硫。
(1)写出第1步反应的化学方程式__________________________________。
(2)在第2步化学反应中,下列原料可以使用的是(用序号填空)__________。写出有关化学反应的方程式_______________________________
①空气 ②氧气 ③硫酸 ④焦炭
(3)在第2步化学反应中,可能会排入空气的气态污染物是________。它(或它们)的主要危害是______________________________