已知A是生活中的一种常见有机物,烃B分子内C、H原子个数比为1︰2,核磁共振
氢谱显示分子中只有一种化学环境的氢原子,D的分子式为C2H4O,各物质有如下转化关系:
请回答下列问题:
(1)A物质的官能团名称是 ; C的结构简式______________;
(2)D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键,D与HCl按物质的量之比1:l反应,原子利用率为100%,则D的结构简式是 ;
(3)甲苯生成甲的反应类型为 ;
(4)乙中有两种含氧官能团,乙与E反应的化学方程式为 ;
(5)普鲁卡因的一种水解产物与甲互为同分异构体,该物质的同分异构体(包含该物质)符合下列条件的有 (填数字)种。
a.分子结构中含苯环,且每个苯环有2个侧链
b.分子结构中一定含官能团—NH2,且—NH2直接与碳原子相连
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I 从废液中提纯并结晶出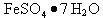 。
。
II将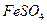 溶液与稍过量的
溶液与稍过量的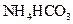 溶液混合,得到含
溶液混合,得到含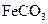 的浊液
的浊液
IV 将浊液过滤,用90。C热水洗涤沉淀,干燥后得到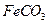 固体
固体
V煅烧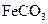 ,得到Fe2O3固体
,得到Fe2O3固体
已知: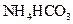 在热水中分解
在热水中分解
(1)I中,加足量的铁屑除去废液中的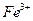 ,该反应的离子方程式是
,该反应的离子方程式是
(2)II中,生成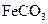 的离子方程式是。若
的离子方程式是。若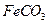 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
(3)IV中,通过检验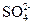 来判断沉淀是否洗涤干净。此操作是
来判断沉淀是否洗涤干净。此操作是
(4)已知煅烧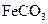 的化学方程式是
的化学方程式是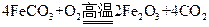 ,现煅烧464.0kg的
,现煅烧464.0kg的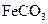 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有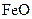 ,则该产品中Fe2O3的质量是kg(摩尔质量/g·
,则该产品中Fe2O3的质量是kg(摩尔质量/g·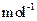 :
: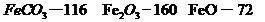 )
)
已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色。
(1)甲同学认为这不是发生化学反应所致,则使溶液呈黄色的微粒是:______ (填粒子的化学式,下同);
乙同学认为这是发生化学反应所致,则使溶液呈黄色的微粒是_________。
(2)如果要验证乙同学判断的正确性,请根据下面所提供的可用试剂,用两种方法加以验证,请将选用的试剂代号及实验中观察到的现象填入下表。
实验可供选用试剂:
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 | D.硫氰化钾溶液 E.硝酸银溶液 F.碘化钾淀粉溶液 |
| 实验方案 |
所选用试剂(填代号) |
实验现象 |
| 方案一 |
||
| 方案二 |
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,则首先被氧化的离子是,相应的离 子方程式为;
子方程式为;
有一种由CO、CO2、H2、水蒸气四种气体组成的混合气体,要证明其中含有CO和 H2,可选用的仪器及药品如下: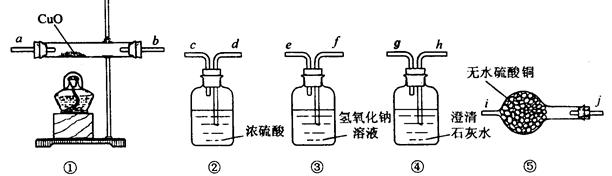
 (1)实验时,导管接口的顺序是。
(1)实验时,导管接口的顺序是。
(2)装置①内发生反应的化学方程式是(任写一个,并标出电子转移方向和数目)。
(3)证明混合气体中含有氢气的实验现象是 。(4)证明混合气体中含有CO的实验现象是。
。(4)证明混合气体中含有CO的实验现象是。
KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少 量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
I.称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;
II. 用微孔玻璃漏斗(无需滤纸)过滤除去难溶的MnO(OH)2;
III. 过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
IV. 利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质,如草酸晶体H2C2O4•2H2O)溶液标定其浓度。已知: MnO4-(H+)→Mn2+、 H2C2O4→ CO2反应中其他元素没有得、失电子。请回答下列问题:
(1)写出在硫酸酸化的条件下KMnO4与H2C2O4反应的离子方程式是;
(2)如何保证在700C-800C条件下进行滴定操作: ;
(3)准确量取一定体积(25.00 mL)的KMnO4溶液使用的仪器是;
(4)若准确称取W g基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾 溶液V mL。问:
溶液V mL。问:
①滴定终点标志是;
②KMnO4溶液的物质的量浓度为mol·L-1;
(5)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将 -------(填“偏高”或“偏低”)
下列实验操作中,正确的是
①称量固体药品时,将药品直接放在天平托盘上。
②实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯
③先将pH试纸用蒸馏水润湿后,再测定溶液的pH
④在量筒中稀释浓硫酸
⑤金属钠保存在CCl4中
⑥金属钠不慎燃烧立即用沙子覆盖
⑦用100mL量筒量取2.50mL盐酸