以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I 从废液中提纯并结晶出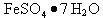 。
。
II将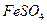 溶液与稍过量的
溶液与稍过量的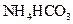 溶液混合,得到含
溶液混合,得到含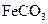 的浊液
的浊液
IV 将浊液过滤,用90。C热水洗涤沉淀,干燥后得到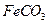 固体
固体
V煅烧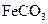 ,得到Fe2O3固体
,得到Fe2O3固体
已知: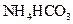 在热水中分解
在热水中分解
(1) I中,加足量的铁屑除去废液中的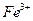 ,该反应的离子方程式是
,该反应的离子方程式是
(2) II中,生成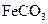 的离子方程式是 。若
的离子方程式是 。若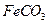 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(3) IV中,通过检验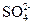 来判断沉淀是否洗涤干净。此操作是
来判断沉淀是否洗涤干净。此操作是
(4) 已知煅烧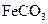 的化学方程式是
的化学方程式是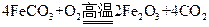 ,现煅烧464.0kg的
,现煅烧464.0kg的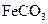 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有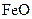 ,则该产品中Fe2O3的质量是 kg(摩尔质量/g·
,则该产品中Fe2O3的质量是 kg(摩尔质量/g·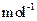 :
: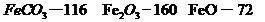 )
)
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下: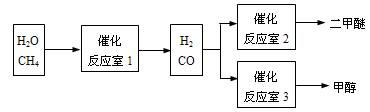
请填空:
(1)写出二甲醚完全燃烧生成二氧化碳和水的化学反应方程式:
__________________________________________________________________。
(2)写出用CO和H2合成甲醇的化学方程式:___________________________________。
(3)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) 。
CO(g)+3H2(g) 。
将1.0 molCH4和2.0 molH2O通人反应室1(容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率v(CH4)=_______________________。
Ⅰ.由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36 L(标准状况)的气体。问: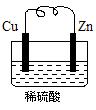
(1)负极是(填“锌”或“铜”),发生反应(填“氧化”或“还原”)。
(2)正极的电极反应为
(3)产生这些气体共需转移电子mol。
Ⅱ.氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答: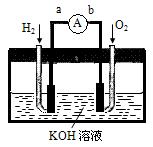
(1)氢氧燃料电池的能量转化主要形式是,在导线中电子流动方向为 (用a、b表示)。
(2)负极反应式为。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一金属锂是一种重要的储氢材料,吸氢和放氢原理为:Ⅰ.2Li+H2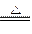 2LiHⅡ.LiH+H2O===LiOH+H2↑
2LiHⅡ.LiH+H2O===LiOH+H2↑
反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。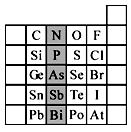
(1)阴影部分元素N在元素周期表中的位置为周期族。根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素Se的最高正价和最低负价的代数和为____________;在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”);
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是_____________。
(4)下列说法不正确的是。
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
以下是元素周期表的一部分,回答下列有关问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑾ |
⑿ |
⑴写出⑥的元素符号:,⑧的离子结构示意图,②的单质的电子式,①的氢化物结构式。
⑵在这些元素中,最不活泼的元素是(用元素符号作答)。
⑶在这些元素的最高价氧化物对应的水化物中,酸性最强的是;(用化学式作答,下同)碱性最强的是;呈两性的氢氧化物的是。
⑷在这些元素中,原子半径最大的是(用元素符号作答)。
⑸这些元素中形成的碱性最强的碱与呈两性的氢氧化物恰好反应的离子方程式是
。
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率VB=__________,该反应的化学反应方程式为____ _______________________。