归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有
c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka,醋酸根水解平衡常数为Kh,水的离子积为Kw,则有:
Ka∶Kh=Kw
| A.①④ | B.①②④ | C.②③ | D.③④ |
在298K、101kPa时,已知:
2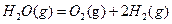 △H1
△H1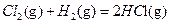 △H2
△H2 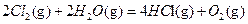 △H3
△H3
则⊿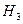 与⊿
与⊿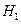 和⊿
和⊿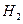 间的关系正确的是
间的关系正确的是
A .⊿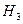 =⊿
=⊿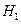 +2⊿
+2⊿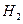 B ⊿
B ⊿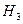 =⊿
=⊿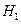 +⊿
+⊿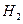
C. ⊿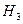 =⊿
=⊿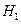 -2⊿
-2⊿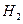 D. ⊿
D. ⊿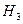 =⊿
=⊿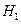 - ⊿
- ⊿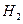
在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
| A.0.225mol/L | B.0.25mol/L | C.0.45mol/L | D.0.9mol/L |
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL OH-浓度为1mol/L的溶液,然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是
向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 molFe,充分搅拌后Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag.。下列结论错误的是
| A.氧化性:Zn2+>Cu2+>Fe3+>Ag+ | B.Fe3+的氧化性大于Cu2+ |
| C.溶液中Cu2+与Fe2+的物质的量比为1∶2 | D.1 mol Fe可还原2 mol Fe3+ |
工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:CuO+2HCl===CuCl2+H2O FeO+2HCl===FeCl2+H2O;已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀 ;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
| A.直接加碱,调整溶液pH≥9.6 | B.加纯铜粉,将Fe2+还 原出来 原出来 |
| C.先将Fe2+氧化成Fe3+,再调整pH在3~4 | D.通入硫化氢,使Fe2+直接沉淀 |