下列说法中正确的是( )。
| A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子 |
| B.NH3、H2O、CH4分子的几何构型均为三角锥形 |
| C.NH3、H2O、CH4分子中的N、O、C原子均是采取sp2杂化的 |
| D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1 |
下列反应既是氧化还原反应,又是吸热反应的是
| A.铝片与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的碳与CO2反应 | D.甲烷气体在O2中的燃烧反应 |
SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是
①KMnO4(H+,aq) ②溴水 ③碘水 ④氯水 ⑤Fe3+(aq)
| A.①⑤ | B.②③④ | C.全部 | D.都不是 |
在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
| A.向氯水中加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 |
| B.溶液呈浅黄绿色,且有强烈刺激性气味,说明有Cl2分子存在 |
| C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明溶液中有Cl-存在 |
| D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO分子存在 |
已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。如表中由实验现象得出的结论完全正确的是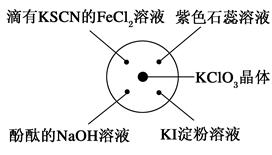
| 选项 |
实验现象 |
结论 |
| A |
滴有KSCN的FeCl2溶液变红色 |
Cl2具有还原性 |
| B |
滴有酚酞的NaOH的溶液褪色 |
Cl2具有酸性 |
| C |
石蕊溶液先变红后褪色 |
Cl2具有漂白性 |
| D |
淀粉KI溶液中变为蓝色 |
Cl2具有氧化性 |
下列有关硅的叙述中,正确的是
| A.工业上通常以SiO2为原料,用氧化剂与其反应制备单质硅 |
| B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一 位 |
| C.硅的化学性质不活泼,在自然界中可以以游离态存在 |
| D.硅在电子工业中,是重要的半导体材料 |