下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )。
A.NH4Cl NH3↑+HCl↑ NH3↑+HCl↑ |
| B.NH3+CO2+H2O=NH4HCO3 |
| C.2NaOH+Cl2=NaCl+NaClO+H2O |
| D.2Na2O2+2CO2=2Na2CO3+O2 |
下列说法正确的是
| A.草酸氢钾溶液呈酸性,在0.1mol·L-1KHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| B.在小苏打水溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| C.相同温度下,1 mol/L氨水溶液与0.5mol/L氨水溶液中,c(OH-)之比是2:1 |
| D.当氨水与盐酸恰好完全反应时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
| A.Ⅱ表示的是滴定醋酸的曲线 |
| B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL |
| C.V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-) |
| D.V(NaOH)=10.00 mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
下图为对15 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像, 根据图像推出X(mol/L)和Y (mol/L)的物质的量浓度是下表内各组中的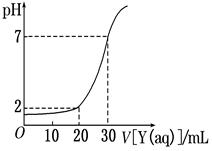
| 选项 |
A |
B |
C |
D |
| c(X)/mol·L-1 |
0.035 |
0.070 |
0.03 |
0.06 |
| c(Y)/mol·L-1 |
0.070 |
0.035 |
0.06 |
0.03 |
一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g)  2C(g) ΔH<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是
2C(g) ΔH<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是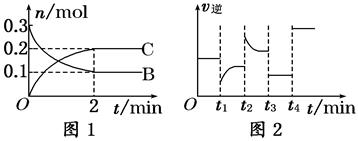
A.反应开始2 min内, v(B)=0.1mol/(L·min)
B.t1时改变的条件可能是升高温度
C.t3时改变的条件可能是加压,此时c(B)不变
D.t4时可能是使用了催化剂,此时c(B)不变
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)  2NH3(g)ΔH=-92.4kJ·mol
2NH3(g)ΔH=-92.4kJ·mol ),下列说法错误的是
),下列说法错误的是
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的平衡浓度(mol·L ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
a1 |
a2 |
a3 |
A.2c1<c3 B.a+b=92.4 C.a1+a3<1 D.p3>2p2=2p1