2014年12月28日,郑州地铁1号线投入试运营,不但缓解了市内交通压力,也改善了我市空气质量。
I.地铁站里氧气含量的测定
地铁站里氧气的含量应与地面保持一致。现有一瓶从地铁站里收集到的空气样品,康康利用如图实验装置测定样品中氧气的含量。请指出测定时需要注意的事项。(至少3条)
Ⅱ,铁的冶炼
地铁的修建需要大量的钢材。康康用下图装置模拟炼铁的化学原理,请写出反应的化学方程式: 。为了提高CO的利用率,你将怎样改进此装置?
Ⅲ.金属材料在地铁方面的应用 在地铁修建过程中使用了大量的金属材料
(1)地铁入口处的雨篷骨架用铝合金而不用纯铁的原因是 。
(2)钢轨用锰钢的原因是 。
(3)出口处的广告架是金属经焊接而成的,焊条的熔点 (填“>”、“=”或“<”)组成焊条的纯属金属的熔点。
Ⅳ.金属的活动性
康康到工地了解了部分金属材料的防锈问题。技术人员告诉他,采用镀锌钢管做水管时,最好不要用铜质接头。为了探究这三种金属的活动性,康康把等表面积的铁片和锌片放入硫酸铜溶液中(如图所示)。
请回答:
(4)如何判断它们是否发生了化学反应?
(5)甲试管中反应前后溶液的质量(填“增重”、“不变”或“减轻”),乙试管中发生反应的化学方程式为 。
(6)上述实验不能够完全证明三种金属的活动性,需要补充的实验操作是 。
Ⅴ.郑州地铁1号线每车次运送乘客约1800人,走同样的路线,CNG公交车每车次消耗天然气akg(以甲烷计算),每辆CNG公交车运送乘客以60名计。若乘CNG公交车的乘客均改乘地铁1号线,则地铁每运行一车次,可减少二氧化碳排放多少千克?
如图所示,这是一瓶无色无味的气体,根据你已有的知识经验,对它的成分进行探究:
(1)假设:它是一瓶气体。
(2)设计实验方案证明你的假设:
步骤:;
现象:;
结论:。
为区别NaOH和Na2CO3两种无色溶液,某同学设计了以下两种实验方案:
方案1:分别取少许两种溶液,各滴入几滴无色酚酞试液,根据酚酞试液是否变红色判断各是哪种溶液?
方案2:分别取少许两种溶液,各加入少量澄清石灰水,根据是否有白色沉淀生成判断各是哪种溶液?请回答:(1)该同学设计的两个方案有一个是正确的,该方案是;另一个方案是不正确的,原因是。
(2)请你再设计一个实验,区别上述两种溶液:
| 实验操作 |
实验现象 |
实验结论和化学反应方程式 |
市场上的薯片、虾条等食品一般采用充气包装,它使用的是什么气体呢?小明和小红对市场上销售的一种虾条发生了兴趣,因为虾条包装在充满气体的小塑料袋内,袋内的气体冲得鼓鼓的。他们认为这种充气包装技术,主要是为了使食品能够较长时间的保鲜、保质。那么,这是什么气体呢?
小红猜想是氮气,小明猜想是二氧化碳。
(1)请你帮助他们设计一个简单的实验方案,来判断小明的猜想是否正确,简要写出操作步骤:,
(2)小明的猜想如果正确,现象应是。
(3)你认为食品充气包装,对所充气体的要求是:(写一点)。
化学小组同学在课外读物中看到:“通常CO2可作灭火剂,但有些物质(如Na)着火,不能用CO2熄灭” 。他们决定探究CO2与Na反应的产物。
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O、Na2CO3。
【查阅资料】
①Na是非常活泼的金属,常温下与O2、H2O等物质反应。
②碱性的Na2CO3溶液与中性的CuCl2溶液发生复分解反应。
③Na2O是白色固体,与H2O反应生成NaOH。
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。
【实验过程】同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)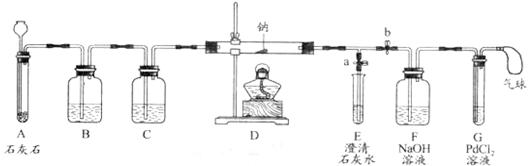
(1)实验记录
| 序号 |
实验操作 |
主要实验现象 |
实验结论和解释 |
| ① |
打开a,关闭b,由长颈漏斗注入稀盐酸 |
A中产生大量气泡 E中出现浑浊 |
E中反应的化学方程式为_____________ |
| ② |
当E中出现浑浊时,打开b,关闭a,点燃酒精灯 |
D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体 G中产生黑色沉淀 |
反应产物一定有_______和_______ |
| ③ |
取D中白色固体于试管中,加水溶解,再加入石灰水 |
产生白色沉淀 |
反应产物还有________ |
(2)实验反思
①实验记录②中,E中出现浑浊,再点燃酒精灯的目的是___________。
②若无装置C,对实验有影响的物质是__________。
③检验第4种物质是否存在的实验方案:取D中白色固体于试管中,
。
下列两组装置图都与我们学过的气体的制取和性质有关。
(1)根据下图(A~E)所给的装置,回答下列问题:
实验室用高锰酸钾制取和收集氧气,可选用的装置为(填字母),反应方程式为;实验室用过氧化氢制取和收集氧气,可选用的装置为(填字母),反应方程式为;实验室制取和收集二氧化碳,可选用的装置为(填字母),反应方程式为。
(2)在实验室中,集气瓶被称做“万能瓶”,用它可以组装成各种用途的装置,请仔细观察下列(F~K)各个装置的特点回答下列问题: 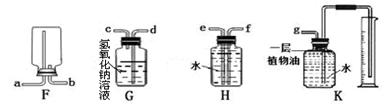
①实验室若用F装置收集氧气,则氧气应从口进入(填导管口的字母代号)。
②若要收集一定体积的二氧化碳气体,应选用装置。
③若要除去一氧化碳中的少量二氧化碳,同时用该瓶收集较纯净的一氧化碳,应选用装置。