化学实验室开放日,小池和小航同学在药品柜中发现一瓶淡黄色粉末,瓶外贴有“过氧化钠(Na2O2)”的标签,这种外观与硫黄相似的物质到底有哪些性质?他们十分好奇,为了弄清它的有关性质,在老师的指导下,他们进行了以下探究活动:
[查阅资料]过氧化钠(Na2O2)在常温下能与水反应生成氢氧化钠和氧气.氢氧化钠能使无色酚酞试液变红色。
[设计实验]过氧化钠与水反应
[进行实验]
| 实验步骤 |
实验现象 |
结论 |
| 1.在试管中加入适量过氧化钠,再加入足量水; |
1.黄色粉末溶解,有 产生 |
产物 (填“有”或“没有”)氧气; |
| 2.用 伸入试管 |
2.木条复燃 |
|
| ③再向试管中加入几滴酚酞试液. |
|
产物有氢氧化钠 |
⑤写出过氧化钠与水反应的化学方程式: 。
金属的生产和利用是人类文明和社会进步的—个重要标志。请根据下图,回答下列问题:
(1)图1探究的是什么?
(2)写出图2所示实验中玻璃管内发生反应的化学方程式。
(3)指出图2实验装置的不足之处。
(4)铝、铁、铜是生活中常用的金属,某同学想用实验验证三种金属的活动性顺序。请你帮他设计一组合理的实验方案(写出步骤和现象即可)。
以下是我们日常生活中常用的各种清洗剂,选择适当的用品可以得到更好的清洗效果。
| 名称 |
洗洁精 |
洁厕灵 |
炉具清洁剂 |
污渍爆炸盐 |
漂白粉 |
| 产品样式 |
 |
 |
 |
 |
 |
| 有效成分 或功能 |
清洗油污 |
盐酸 |
氢氧化钠 |
过碳酸钠 |
消毒 |
(1)使用洗洁精清洗餐具上的油污,这是因为它具有的功能。
(2)以下物质可以使用洁厕灵清洗的是(填字母序号)。
a.铁锈 b.油渍 c.水垢(主要成分为碳酸钙和氢氧化镁)
(3)取上述一定量的炉具清洁剂,滴加几滴酚酞溶液,溶液变色,若将洁厕灵与炉具清洁剂混合,可以发生下图所示的化学反应。图中a微粒的名称为。
(4)“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,再加入足量的洁厕灵,发生的化学反应方程式为。
(5)化学小组发现一袋包装破损的漂白粉,同学们对漂白粉其漂白作用是否失效产生了疑问。(当有效成分完全消失时,则漂白粉就完全失效;部分消失时,则为部分失效)。
【查阅资料】
①漂白粉的主要成分是Ca(ClO)2、CaCl2和Ca(OH)2,其有效成分是Ca(ClO)2。
②Ca(ClO)2可溶于水,漂白原理是:它在空气中发生反应: Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO, 
③ HClO不稳定,易分解生成HCl和一种常见的单质气体。
④ CaCl2的水溶液呈中性,HClO的水溶液呈酸性。
⑤ HClO能可使有色物质(如:品红溶液)褪色。
【实验探究】下表是探究某漂白粉是否完全失效的实验,请根据表中结论,进行填空。
| 实验步骤 |
实验现象 |
实验结论 |
| 把少量漂白粉样品加入水中,通入足量的CO2气体, 。 |
漂白粉的漂白作用已完全失效 |
【继续探究】同学们对某完全失效后的漂白粉的成分很感兴趣,并作进一步探究。在老师的帮助下,同学们对该失效后的漂白粉成分进行猜想:
猜想一:CaCl2和CaCO3;猜想二:。然后进行实验探究。
| 实验操作 |
实验现象 |
实验结论 |
| 把样品加入水中,充分溶解后过滤,_______________。 |
______________ |
猜想一成立 |
【交流讨论】
①HClO分解时除生成HCl外,生成的另一种常见气体是。
②猜想中的成分CaCO3,除漂白粉的有效成分在空气中发生反应生成外,还有其它来源,请你用化学方程式表示。
【定量研究】取上述漂白粉31.1g于一烧杯中,向其中加入131.7g水,使漂白粉中的可溶物完全溶解。然后再向其中逐滴加入溶质质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图所示。请根据题意回答下列问题:
①当滴入10%的稀盐酸至图中A点时,烧杯中溶液里含有的溶质是(写化学式)________。
②当滴入10%的稀盐酸146g时(即B点),试通过计算,求此时烧杯中所得不饱和溶液中溶质的质量分数。
随着人们生活水平的提高,人们对于食品不但要求营养,更要求健康。市场上出现了一些不添加防腐剂的绿色食品,这种食品中有一个单独包装的保鲜剂,不会危害食品安全。某同学找来一种在空气中放置一段时间的食品保鲜剂,对它进行探究。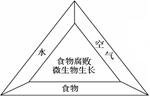
【查找资料】
(1)食物腐败是因为微生物在食物上生长。如右图所示,微生物只要得到养分,再加上充足的氧气和水,在适当的条件下就会迅速生长。因此,只要缺少一种条件,就可以防止食物腐败。
(2)常见的具有吸水性的物质有以下几种:
①浓硫酸 ②生石灰 ③氢氧化钠固体 ④铁粉 ⑤硅胶(化学式SiO2。nH2O,无色透明粒状固体,无毒无害)
【活动与探究】
(3)初步探究:你认为①~⑤的物质中,不适合做食品干燥剂的是 ,理由是 。
(4)实验探究:
| 实验 |
操作 |
主要现象 |
结论与解释 |
||
| 实验1 初步判断 |
打开这种保鲜剂的包装袋,取少量样品于试管中,进行观察。 |
该样品为黑色 固体 |
该保鲜剂一定不是 。 |
||
| 实验2 对该保鲜剂的有效性进行探究 |
向实验1的试管中加入过量的稀盐酸,振荡。 |
有气泡产生,溶液逐渐变成浅绿色。 |
该保鲜剂: 。 |
||
| 实验3 对该保鲜剂的成分进行探究 |
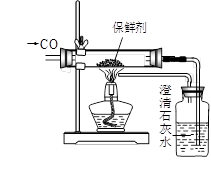 |
澄清石灰水变浑浊。 |
该保鲜剂中一定含有的物质是 。 |
【活动反思】
(5)实验2充分反应后试管中所得溶液中的溶质可能是 。(友情提示:在溶液中可发生Fe+2FeCl3=3FeCl2反应)。
(6)请根据食物腐败的条件分析,我们除可以使用这些保鲜剂外,还可以采用的保鲜方法是 。(写出一种即可)
水田或池塘里常常不时地冒出一些气泡,几位同学决心弄清这种气泡的成分。请你与他们一起完成如下的探究:
【对气体猜想】
猜想I:全部是CH4; 猜想Ⅱ:全部是CO2; 猜想Ⅲ:是CH4和CO2的混合气体。
【气体的收集】
他们设计了如右图所示的取气方法:将空的雪碧汽水塑料瓶装满水,倒放在池塘中,瓶口对准水底冒出的气泡收集。这种集气方法叫。针对瓶口太小不便于收集的特点,在不换瓶的情况下你的改进方法是。
【实验和推断】
如图1,将雪碧瓶(A)中收集到的气体依次通入B、C中,在D处点燃。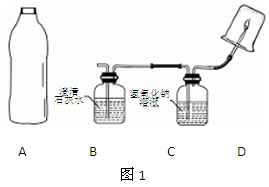
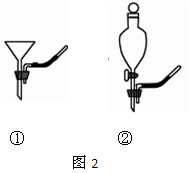
(1)要将A中的气体通入后面的装置中,应选图2中的(填序号)“注水装置”。(2)若B中石灰水变浑浊,则说明A中的气体中含有气体。
(3)装置C作用是。
(4)若D处倒扣的是涂有澄清石灰水的烧杯,出现浑浊,且B中无明显现象,则“猜想”成立。若D处倒扣的是干冷的大烧杯,杯壁有水雾出现,有同学认为“猜想I、Ⅲ”可能成立,另有同学认为此现象不能证明收集到的气体中一定含有CH4,理由是气体通过B、C装置时,会带入水蒸气,要排除这种干扰可采取的措施是。
(5)采取(4)中的排除干扰措施后,若D处分别倒扣干冷的烧杯和涂石灰水的烧杯,分别出现水雾和浑浊,且B中也出现浑浊,则证明“猜想”成立。
某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一装溶液的试剂瓶未盖瓶塞且标签破损,于是决定对这瓶溶液进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【提出猜想】这瓶溶液是:
猜想一:氯化钠溶液;猜想二:氢氧化钠溶液;猜想三:碳酸钠溶液。
【实验推断】
(1)小丽取样滴加无色酚酞溶液,溶液呈红色,得出结论:该溶液不可能是溶液,
理由是。
(2)小刚另取样滴加稀盐酸有产生,反应的化学方程式为,
小刚得出结论:该溶液是碳酸钠溶液。
(3)小青认为小刚的结论不完全正确,理由是。
小组同学讨论后一致认为还需要进行如下实验:
【继续探究】为了完全除去溶液中的Na2CO3,另取样加入过量的CaCl2溶液,观察到有产生。静置后,取上层清液,滴入酚酞溶液,溶液呈红色。
【实验结论】这瓶溶液是。
【探究启示】
实验过程中取完药品后应立即盖好瓶塞。
【拓展迁移】
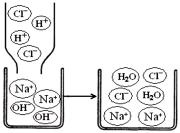
若该溶液与盐酸发生中和反应,恰好完全反应的微观过程如右图所示,则反应后溶液中存在的阴、阳离子是(填符号)。