化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1________m2(选填“<”、“=”或“>”)。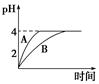
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加NaOH溶液,使溶液pH为________。
(3)10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度/℃ |
10 |
20 |
30 |
加热煮沸后冷却到50 ℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
在分析该溶液pH增大的原因时,甲同学认为是升高温度HCO3-的水解程度增大所致;乙同学认为是溶液中升高温度NaHCO3受热分解生成Na2CO3,CO32-水解程度大于HCO3-所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)________________________________________________________________________。
CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)水钴矿进行预处理时加入Na2SO3的主要作用是 。
(2)写出NaClO3在浸出液中发生主要反应的离子方程式_______________________;
若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________________。
(3) “操作1”中包含3个基本实验操作,它们依次是_______________、________________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为 。
(5)萃取剂的作用是 。
(6)为测定粗产品中CoCl2·6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克。则粗产品中CoCl2·6H2O的质量分数是________________。
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示: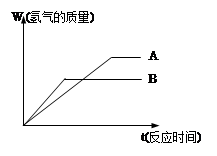
(1) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙丙三组实验,三组实验各取500mL同浓度的盐酸溶液加入该种混合粉末,产生气体,有关数据如下:
实验序号甲乙丙
混合粉末质量(g)6.2 18.6 24.8
生成气体气体(mL) 2240 5600 5600
①乙组实验中,盐酸________(填“过量”、“适量”或“不足量”)
②上述所用的盐酸的物质的量浓度为_________mol/L,混合粉末的平均摩尔质量是________。
镁合金是重要的民用和航空材料,镁作为一种强还原剂,还用于钛、镀和铀的生产,氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等。
(1)氧化镁的电子式为________。
(2)写出镁与TiCl4在高温条件下制取钛的化学方程式____________________。
(3)从海水中提取金属镁用到的主要化学药品有________________。
(4)某研究小组同学在实验室用卣块制备少量Mg(ClO3)2·6H2O,其流程如下: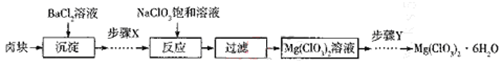
已知:I卤块主要成分为Mg Cl2·6H2O,含有MgSO4、FeCl2等杂质。Ⅱ可选用的试剂:H2O2,稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
①加入BaCl2溶液的目的是____________。
②步骤X中需将Fe2+转化为Fe3+,所选的试剂为__________。
③Mg(ClO3)2加入到含有KSCN的FeSO4酸性溶液中立即出现红色,写出相关反应的离子方程式:________________________________________.
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+ I2(g) 2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为 。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 。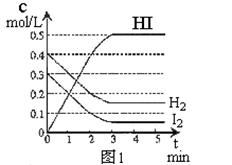
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K (填写增大、减小或不变),HI浓度的变化正确的是 (用图2中a-c的编号回答)。
②若加入I2,则H2浓度的变化正确的是 (用图2中d-f的编号回答)。
根据要求回答下列各题:
(Ⅰ)现有①Na2O ②SO3 ③铁 ④蔗糖 ⑤冰醋酸(纯醋酸晶体) ⑥KNO3晶体 ⑦氢氧化钠溶液等物质,请填空回答(填序号):以上物质在常温下
(1)能导电的是 ;(2)属于非电解质的是 ;
(3)属于电解质的是 ;(4)属于弱电解质的是 。
(Ⅱ)写出下列反应的化学方程式:
(1)有H2O参加的化合反应: ;(2)有H2O生成的分解反应: ;
(3)有HCl生成的置换反应: ;(4)有HCl参加的复分解反应: 。
(Ⅲ)某有机混合物4.6 g完全燃烧,将燃烧后的混合物通入过量的澄清石灰水,石灰水共增重14.2 g,经过滤得到20g沉淀.该有机样品可能是:
| A.C2H6O2 |
| B.CH4和C2H6的混合物 |
| C.C2H6O和C3H8O3的混合物 |
| D.CH4O和C3H8O的混合物 |