下列说法正确的是
| A.形成离子键的阴阳离子间只存在静电吸引力 |
| B.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 |
| C.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |
关于镀铜和电解精炼铜,下列说法中正确的是( )
| A.都用粗铜作阳极、纯铜作阴极 |
| B.电解液的成分都保持不变 |
C.阳极反应都只有Cu-2e- Cu2+ Cu2+ |
D.阴极反应都只有Cu2++2e- Cu Cu |
关于电解NaCl水溶液,下列叙述正确的是( )
| A.电解时在阳极得到氯气,在阴极得到金属钠 |
| B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 |
| C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色 |
| D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 |
用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量水能使溶液恢复到电解前的浓度的是( )
| A.AgNO3 | B.Na2SO4 | C.CuCl2 | D.HCl |
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述中正确的是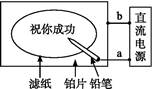
| A.铅笔端作阳极,发生还原反应 |
| B.铂片端作阴极,发生氧化反应 |
| C.铅笔端有少量的氯气产生 |
| D.a点是负极,b点是正极 |
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+ Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
| A.该装置可能是原电池,也可能是电解池 |
| B.该装置只能是原电池,且电解质溶液为硝酸 |
| C.该装置只能是电解池,且金属铜为该电解池的阳极 |
| D.该装置只能是原电池,电解质溶液不可能是盐酸 |