目前下列工艺过程没有直接使用离子交换技术的是( )。
| A.硬水的软化 |
| B.电解饱和食盐水制造NaOH |
| C.电渗析法淡化海水 |
| D.海水中提取金属Mg |
100gC不完全燃烧所得产物中,CO所占体积为1/3,CO2为2/3,且:
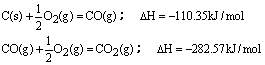
与这些碳完全燃烧相比,损失的热量为( )
| A.39.292kJ | B.3274.3kJ | C.784.92kJ | D.2489.44kJ |
已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625kJ·g-1。下列热化学方程式中不正确的是( )
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-890kJ/mol |
B.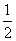 CH4(g)+O2(g)= CH4(g)+O2(g)=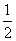 CO2(g)+H2O(l);△H=-445kJ/mol CO2(g)+H2O(l);△H=-445kJ/mol |
C.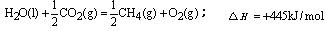 |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-55.625kJ/mol |
热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
| A.碳和水反应吸收131.3kJ能量 |
| B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 |
| C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
| D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ |
已知 有相同容积的定容密封容器甲和乙,甲中加入 和 各0.1 ,乙中加入 0.2 ,相同温度下分别达到平衡。欲使甲中 的平衡浓度大于乙中HI的平衡浓度,应采取的措施是()
| A. | 甲、乙提高相同温度 | B. | 甲中加入0.1 ,乙不改变 |
| C. | 甲降低温度,乙不变 | D. | 甲增加0.1 ,乙增加0.1 |
在含有NaI、FeBr2和Na2SO3各1 mol的溶液中通入足量的Cl2,将溶液在空气中加热蒸干并充分灼烧,最终得到剩余的固体物质是()
| A.NaCl、FeCl3、Na2SO4 | B.NaCl、FeBr3、Na2SO4 |
| C.NaI、FeCl3、Na2SO3 | D.NaCl、Fe2O3、Na2SO4 |