开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。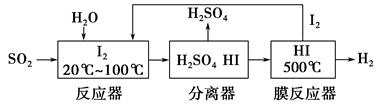
请回答下列问题:
(1)已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为________________________________________________________。
(2)该循环工艺过程的总反应方程式为_____________________________________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_______________________________________________________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,负极的电极反应式为______________________________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为____________________________。
按要求完成各题
(1)已知,1mol N2(g)与足量O2(g)起反应,生成2mol NO2(g),吸收68 kJ的热量。该反应的热化学方程式可表示为:
(2)写出下列各物质的电离方程式:
CH3COOH
NH3·H2O (3)写出下列各物质水解的离子方程式:
(3)写出下列各物质水解的离子方程式:
NaHCO3
AlCl3
(4)把足量的碳酸钙粉末放入水中,建立的溶解平衡可表示为:
在0.1 mol/L氨水中,分别加入少量下列物质,溶液中的c(OH-)如何变化?(填“增大”、“减小”或“不变”)
⑴加少量HNO3溶液____________⑵加少量KOH溶液___________
⑶加少量(NH4)2SO4固体__________(4)加大量水__________
在有机化合物分子中,常把连有4个不同的原子或原子团的饱和碳原子称为不对称碳原子,可用*C标记,例如:
丙烷进行氯代反应中,可分离出4种二氯代物A、B、C、D,分子式均为C3H6Cl2。当它们进一步氯代为三氯代物时,A只有一种三氯代物,B有2种三氯代物,C和D各有3种三氯代物,已知C具有不对称碳原子,试写出A、B、C、D的结构简式:A________ B___________ C____________ D___________。
(1)下列叙述中,正确的是(填写序号)。
①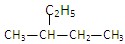 的化学名称是2—乙基丁烷
的化学名称是2—乙基丁烷
②有机物用NaOH水溶液水解后,加AgNO3溶液有沉淀产生,则该有机物为卤代烃
③能聚合成高分子化合物的单体中都含有碳碳双键
④苯和甲苯可以用0.1%KMnO4酸性溶液鉴别
(2)写出下列反应的化学方程式,并指出反应类型:
①把Cl2通入含铁的苯中()
②把浓H2SO4、浓HNO3和甲苯混合加热制备TNT( )
③由丙烯制备聚丙烯()
④甲苯在催化剂存在条件下加热与H2反应()
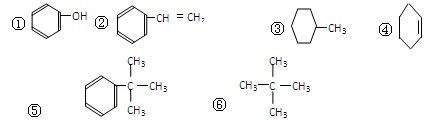
下列有机物中(1)属于脂肪烃的是_______________(填符合题意各物质的序号,下同),(2)属于芳香烃的是________,(3)属于苯的同系物的是________。(4)属于脂环烃的是