丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂: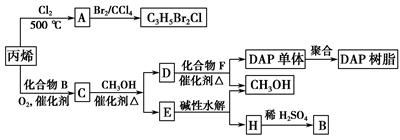
已知酯与醇可发生如下酯交换反应:
RCOOR′+R″OH催化剂△RCOOR″+R′OH(R、R′,R″代表烃基)
(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
①A的结构简式是____________________________________________________,
A含有的官能团名称是________;
②由丙烯生成A的反应类型是________。
(2)A水解可得到D,该水解反应的化学方程式是_____________________________________。
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%。C的结构简式是________。
(4)下列说法正确的是(选填序号字母)________。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环用于DAP树脂的制备。其中将甲醇与H分离的操作方法是________。
(6)F的分子式为C10H10O4。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是_______________________________________________________________。
(12分)下表为元素周期表的一部分,按要求完成各小题。
 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
⑥ |
⑦ |
⑾ |
|||||
| 3 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 4 |
② |
④ |
⑨ |
化学性质最不活泼的元素 (填元编号,下同),非金属性最强的元素是金属性最强的单质与水反应的离子方程式为
①③⑤三种元素的最高价氧化物水化物中,碱性最强的
①③⑤三种元素的原子半径由大到小的顺序为
某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素为 在两种盐中该元素的化合价为,该元素的最高价氧化物和盐酸反应的化学方程式为 向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为
下面是你熟悉的物质:
①O2② 金刚石 ③ NaBr ④ H2SO4⑤ Na2CO3⑥ K2S⑦NaHSO4这些物质中,只含共价键的是_______________;只含离子键的是___________;既含共价键又含离子键的是_______________。
将NaHSO4溶于水,写出其电离方程式______________________________。
现有6种短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| W |
周期表中原子半径最小的元素 |
| U |
地壳中含量最多的金属元素 |
| R |
单质为空气的主要成分之一 |
| T |
M层上有6个电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
完成下列空白(涉及W、U、R、T、X、Y、Z时,用元素符号表示):元素T的原子共有个电子;元素X的一种核素可测定文物年代,这种核素的
符号是。用电子式表示:
①气态化合物XR2_________________;
②元素W、R形成的10电子分子的形成过程______________________________。元素Z与元素T相比,非金属性较强的是,下列表述中能证明这一事实的
是(填序号)。
a. 常温下Z的单质和T的单质状态不同
b. Z的氢化物比T的氢化物稳定
c. 一定条件下Z和T的单质都能与氢氧化钠溶液反应
下表是元素周期表的一部分,请回答有关问题:
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||||||
| 2 |
① |
② |
③ |
|||||||||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||||||||
| 4 |
⑨ |
⑩ |
表中化学性质最不活泼的元素,其原子结构示意图为 。
表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 。
①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
③元素与⑩元素两者核电荷数之差是 。
设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 |
实验现象与结论 |
拆开1mol H—H键,1mol N—H键,1mol N三N键分别需要吸收的能量为436kJ ,391kJ,946kJ:则理论上,每生成1mol NH3,热量(填:吸收或放出)kJ;事实上,反应的热量总小于理论值,为什么?