常温下,用 0.01 mol·L-1NaOH溶液滴定 20.00 mL 0.01 mol·L-1 CH3COOH溶液,所得滴定曲线如图。下列说法正确的是
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+ c(CH3COO-) = c(Na+)+ c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
某恒温密闭容器中,可逆反应A(s)  B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
反应aM(g)+bN(g)  cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )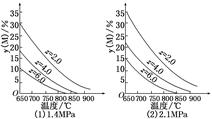
| A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加 |
| B.同压同z时,升高温度,平衡时Q的体积分数增加 |
| C.同温同z时,增加压强,平衡时Q的体积分数增加 |
| D.同温同压时,增加z,平衡时Q的体积分数增加 |
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是()
2SO3(g),能增大正反应速率的措施是()
| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO3 | D.降低体系温度 |
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,由此可判断
C(g)+D(g)过程中的能量变化如图所示,由此可判断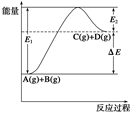
| A.1molA与1molB充分反应后,能量变化为ΔE |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
对于可逆反应mA(g)十nB(g) pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是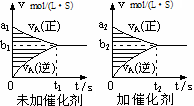
| A.b1>b2,t1>t2 |
| B.两图中阴影部分面积一定相等 |
| C.A的平衡转化率(II)大于(Ⅰ)中A的转化率 |
| D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大 |