某实验小组同学探究铜与硝酸的反应。
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10 mL硝酸溶液分别与铜片反应,实验记录如下:
| 序号 |
浓硝酸与水的体积比 |
实验现象 |
| Ⅰ |
1:1 |
反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ |
1:3 |
反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ |
1:5 |
反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
铜与稀硝酸反应的离子方程式为 ;若生成标准状况下0.56 L NO气体,反应中被还原的HNO3的质量为 g(小数点后保留两位有效数字)。
依据上表,制备NO气体最适宜的是实验II,理由是 。
(2)为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如右图所示(夹持仪器略去)。
用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性。
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触铜丝)。
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始。
Ⅳ.当液面重新下降至与铜丝脱离接触时,反应停止。
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象。
……
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到 ,说明装置的气密性良好。
②步骤Ⅲ操作的目的是 。
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是 ,能确定NO完全被溶液吸收的现象是 。
氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图C装置中球形干燥管的作用是。
(2)完成以下实验步骤:组装好实验装置,首先___________,再加入实验药品。接下来的实验操作是,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是。
(3)若去掉装置B,则导致测定结果(填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见。
【方案2】按以下步骤测定样品中A1N的纯度:
(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作是。A1N的纯度是(用m1、m2表示)。
【实验化学】硫酸锌是一种重要的工业原料。在实验室从粗锌(含有少量的铅)与稀硫酸反应后的废液中提取硫酸锌的主要操作步骤如下:
步骤1:将废液过滤,调节滤液的pH约为2,过滤,将滤液加热浓缩,制得较高温度下的饱和溶液,冷却结晶得到粗制晶体。
步骤2:①在烧杯中用蒸馏水溶解步骤1得到的晶体,滴加少量稀硫酸,水浴加热至晶体全部溶解。
②停止加热,让其自然冷却、结晶。
③抽滤,用少量无水乙醇洗涤晶体1~2次,得精制晶体。
(1)废液中含有的不溶性杂质是________。
(2)步骤1中调节滤液pH约为2,可加入的物质是________(填字母)。
a.NH3·H2Ob.ZnOc.ZnCO3d.NaOH
(3)步骤1中对滤液加热浓缩时,当________时,停止加热。
(4)步骤2中滴加少量稀硫酸的目的是____。
(5)抽滤装置如图所示,仪器B的名称是________。仪器C的作用是____________。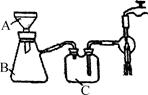
(6)用少量无水乙醇洗涤晶体的目的是________。
(15分)CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
| H2O2/% |
5 |
10 |
15 |
20 |
25 |
30 |
| CaO2/% |
62.40 |
63.10 |
63.20 |
64.54 |
62.42 |
60.40 |
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:____。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05 g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入30 mL蒸馏水和2 mL盐酸(3 mol·L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5 mL KI溶液(100 g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后________,用硫代硫酸钠标准溶液继续滴定,________,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2===Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是____。
(3)加入KI溶液后发生反应的离子方程式为____。
(4)请补充完整实验步骤4中的内容:____________;____________。
Ⅲ.测定含有CaO杂质的CaO2含量的实验方法较多,某同学设计了仅用稀盐酸一种药品(仪器可任选)较为准确地测出CaO2含量的实验,请你帮该同学列出所需仪器清单(实验用品和用于固定的或连接的仪器可不写)。
(5)仪器:________________________。
(12分)锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
(1)锌浮渣利用硫酸浸出后,将滤渣1进行再次浸出,其目的是____。
(2)净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:____。
(3)90℃时,净化2溶液中残留铁的浓度受pH影响如右图所示。pH较小时,虽有利于Fe2+转化为Fe3+,但残留铁的浓度仍高于pH为3~4时的原因是____________________________。
(4)滤渣3的主要成分为________(填化学式)。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:____;碳化时所用NH4HCO3的实际用量为理论用量的1.1倍,其原因一是为了使Zn2+充分沉淀,二是____________。
【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
B.[实验化学]卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化。某实验小组通过如下实验对卷心菜中维生素C的含量进行测定。
第一步:配制维生素C标准溶液。将5片100 mg的维生素C药片碾碎、溶解,配成250 mL标准溶液。
第二步:制取卷心菜汁。取50 g新鲜的卷心菜,捣烂,加水充分搅拌,用下图所示装置抽滤制得卷心菜汁50 mL。
第三步:标准溶液中维生素C含量的测定。移取20.00 mL维生素C标准溶液于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V1。
第四步:卷心菜汁中维生素C含量的测定。移取20 mL卷心菜汁于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0. 010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V2。
(1)与过滤相比,抽滤的优点是 。抽滤所用的滤纸应略 (填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。
(2)移取20.00 mL待测液选用的仪器是 ,滴定终点溶液的颜色呈 色。
(3)上述滴定过程滴定速度要快,否则将会使测得的维生素C的含量偏低,其可能的原因是 。
(4)1kg卷心菜中所含维生素C相当于 片上述维生素药片。(用含V1、V2的代数式表示)