(一)在含有物质的量各为0.1 mol FeCl3、H2SO4、Cu(NO3)2的溶液500 mL中,逐渐加入铁粉,溶液中n(Fe2+)与加入n(Fe)的关系如图A(请注意识图,该题图中每小正方格长度为0.05mol)。(提示:忽略离子水解产生的影响;如果有硝酸根被还原时,则生成一氧化氮气体)
(1)写出图中n(Fe)从0.125mol-0.225 mol段对应反应的离子方程式____。
(2)写出图中n(Fe)从0-0.05 mol段对应反应的离子方程式____。
(3)请在图B中画出溶液中n(Fe3+)与加入n(Fe)的变化关系图
(4)当反应进行到最后,取该溶液2mL加入试管中,为了证明该溶液中有NO3-存在,可以向试管中在滴加_______。
| A.酸性KMnO4溶液 | B.含有盐酸的KSCN溶液 | C.碘水 | D.次氯酸钠溶液 |

(二)下图是电解槽的剖面图,箭头的方向指的是气体或溶液的流向,阳离子交换膜只允许阳离子通过。现要用此装置来通过电解分离Na2SO4和NaOH的混合溶液,则向装置中通入A1溶液和A2溶液(A1溶液是Na2SO4和NaOH的混合溶液,A2溶液是NaOH的稀溶液)。电解一段时间后,装置中流出:B2溶液(是NaOH的浓溶液)和B1溶液,C1气体和C2气体。
(1) C2气体是______(填化学式)。
(2)请写出阳极反应的电极方程式 .
(3)请简述阴极室能流出NaOH的浓溶液的原因 .
在真空中,用高能电子轰击一种气体分子时,分子中的一个电子可以被轰击出去,生成阳离子自由基。如苯甲酸分子被轰击:
C6H5COOH® C6H5COOH++e
其阳离子的式量与所带电荷数之比( )为122(即
)为122(即 ),与此同时,这样的离子还会被轰击成其它形式的碎片离子(都只带一个单位的正电荷)。各有它们的
),与此同时,这样的离子还会被轰击成其它形式的碎片离子(都只带一个单位的正电荷)。各有它们的 ;由苯甲酸形成的碎片离子按所测得的
;由苯甲酸形成的碎片离子按所测得的 大小排列有:122、105、77、51……。
大小排列有:122、105、77、51……。
 |
碎片离子 |
有关反应 |
| 105 |
C6H5CO+ |
C6H5COOH+® C6H5CO++OH |
| 77 |
C6H5+ |
C6H5CO+® C6H5++CO |
| 51 |
C4H3+ |
C6H5+®C4H3++C2H2 |
| …… |
…… |
…… |
现有中学常用的有机化合物A,仅由C、H、O元素组成,通常A是一种无色透明的液体,不溶于水,加热后能逐渐溶于稀NaOH溶液或稀H2SO4溶液,冷却后不再析出原有的液体。若用高能电子束轰击气体A分子时,在70eV下可得 为88、73、61、45、29、27、15等的离子(均只带一个正电荷)。回答下列问题:
为88、73、61、45、29、27、15等的离子(均只带一个正电荷)。回答下列问题:
(1)有机物A的相对分子质量是 ,分子式是 ;
(2) 为88的离子是 ;
为88的离子是 ;
(3) 为15的离子是 。
为15的离子是 。
W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
⑴写出元素符号:W为_____,X为____,Y为_____,Z为____。
⑵W2Z是由________键组成的分子,其电子式为___________。
⑶由Y、X、W组成的物质中有____________键和__________键组成的___________化合物。⑷Z的最高价与X形成的化合物属于_____性分子(填极性或非极性,下同),W2Z属于_____性分子。
近期,科学家用NaNO3和Na2O在573K反应制得了离子化合物Na3NO4。
(1)经测定,Na3NO4中各原子最外层电子数都达到了8电子稳定结构,则NO43-的电子式为______________________。
(2) Na3NO4与CO2能剧烈反应,并转化为常见物质,写出这个反应的化学方程式:
________________________________、_________________________________。
(3) Na3NO4与H2O能剧烈反应,并转化为常见物质,写出这个反应的化学方程式:
________________________________、_________________________________。
取化学式为MZ的黄色粉末状化合物进行如下实验。将MZ和足量碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按图连接仪器。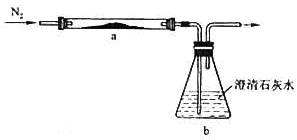
实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。此时,管中的熔融触物凝固成银白色金属。根据以上叙述回答问题:
(1)元素Z是 。
(2)停止加热前是否需要先断开a和b的连接处?为什么?
;
(3)反应管a中发生的所有反应的化学方程式是 ;
(4)本实验的尾气是否需处理?如需处理,请回答如何处理:如不需处理,请说明理由。
。
碳酸钠与工农业生产、日常生活紧密相关。工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀________(填操作)、洗涤、烘干、称量。洗涤沉淀的操作是 ______________________________ 。
方案二:气体分析法
(2)把一定量的样品与足量盐酸反应后,用下图装置测定产生CO2气体的体积,为了测量结果准确,B中的溶液最好采用___________________,但选用该溶液后实验结果仍然不够准确,其原因是_______________________。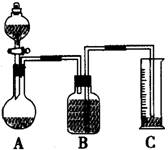
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用下图所示装置,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差求算样品的纯度。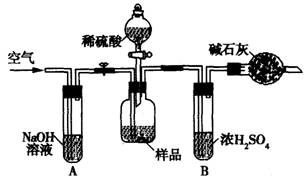
该实验的操作步骤有:①在干燥管内填满碱石灰,质量为mg②取ng样品装入广口瓶中
③检验装置的气密性④缓慢鼓人空气数分钟,再称量干燥管质量为Mg⑤关闭止水夹
⑥打开止水夹⑦缓慢加入稀硫酸至不再产生气体为止⑧缓慢鼓人空气数分钟
Ⅰ.正确的操作顺序是(填写序号):③→_________→⑥→______⑤→________⑦→______
Ⅱ.在操作④中,要缓慢鼓人空气数分钟,鼓人空气的作用是_________ ;装置A的作用是 _________;装置B的作用是 _____________。
Ⅲ.若去掉装置A,测定结果______________ ;若去掉装置B,测定结果_________ (填“偏大”、“偏小”或“无影响”)。