苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:
已知:
| 名称 |
相对分子质量 |
颜色,状态 |
沸点(℃) |
密度(g·cm-3) |
| 苯甲酸* |
122 |
无色片状晶体 |
249 |
1.2659 |
| 苯甲酸乙酯 |
150 |
无色澄清液体 |
212.6 |
1.05 |
| 乙醇 |
46 |
无色澄清液体 |
78.3 |
0.7893 |
| 环己烷 |
84 |
无色澄清液体 |
80.8 |
0.7318 |
*苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入12.20 g苯甲酸,25 mL 95%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是 (填入正确选项前的字母)。
A.25 mL B.50 mL C.100 mL D.250 mL
(2)步骤①中使用分水器不断分离除去水的目的是 。
(3)步骤②中应控制馏分的温度在 。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(4)步骤③加入Na2CO3的作用是 ;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是 。
(5)关于步骤③中的萃取分液操作叙述正确的是
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为 。
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题: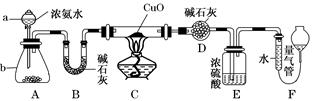
(1)仪器a的名称为________;仪器b中可选择的试剂为________。
(2)实验室中,利用装置A还可制取的无色气体是________(填字母)
| A.Cl2 | B.O2 | C.CO2 | D.NO2 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有________性,写出相应的化学方程式___________________________
________________________________________________________________________。
(4)E装置中浓硫酸的作用______________________________________________。
(5)读取气体体积前,应对装置F进行的操作:_______________________________________________________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH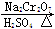 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ |
密度/(g·cm-3) |
水中溶解性 |
|
| 正丁醇 |
117.2 |
0.810 9 |
微溶 |
| 正丁醛 |
75.7 |
0.801 7 |
微溶 |
实验步骤如下:
将6.0 g Na2 Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由______________________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是________。
(3)上述装置图中,B仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分离水时,水在________层(填“上”或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________________________________。
某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图:
可供选择的试剂:饱和Na2CO3溶液,饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、KMnO4溶液(H+)、稀盐酸。
请根据流程图,回答相关问题:
(1)试剂a应该选用________。
(2)操作①②③④⑤的名称是________(填序号)。
| A.萃取、过滤、分液、过滤、蒸发结晶 |
| B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 |
| D.萃取、分液、分液、过滤、蒸发结晶 |
(3)除去无色液体Ⅰ中的Ca2+、Mg2+、SO42-,选出试剂b(试剂b代表一组试剂)所代表的试剂,按滴加顺序依次是______________________(填化学式)。
(4)调节pH的作用是________,操作方法是_____________________________________
________________________________________________________________________。
(5)操作⑤中用到的瓷质仪器名称是__________________________________________。
下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。请回答下列问题:
(1)能用作干燥氨气的装置有________(填字母)。
(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有________(填字母)。
(3)在氯气和铁反应的实验中,能添加在制氯气和反应装置之间以除去氯气中氯化氢等杂质气体的装置有________(填字母)。
(4)能用于乙烯与溴水反应制二溴乙烷的实验装置有________(填字母)。
(5)若用C装置作二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶的作用是________________________________________________________________________。
(6)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了如图所示的实验。
①可通过观察__________________的现象来定性比较得出结论。
②有同学提出将CuSO4改为CuCl2更为合理,其理由是____________________,你认为还可以作何改进?___________________。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了下图所示装置进行有关实验: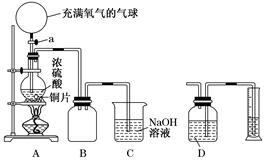
(1)先关闭活塞a,将6.4 g铜片和10 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中圆底烧瓶内发生反应的化学方程式:
打开活塞a之前___________________________________________________;
打开活塞a之后___________________________________________________。
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整。
(2)实际上,在打开活塞a之前硫酸仍有剩余。为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量。他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下)。你认为甲学生设计的实验方案中D装置中的试剂为______________________(填化学式)。
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100 mL溶液,再取20 mL于锥形瓶中,用________作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为__________________________________________________;再求出余酸的物质的量,若耗去a mol/L氢氧化钠溶液b mL,则原余酸的物质的量为________mol(用含a、b的表达式来表示)。