碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,2C(s) +O2(g) =2CO(g) △H= 。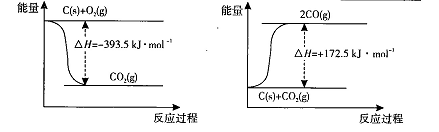
(2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<O测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如图所示:
CH3OH(g)+H2O(g) △H<O测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如图所示: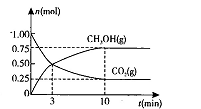
①从反应开始到平衡,H2O的平均反应速率v(H2O)= 。
②下列措施中能使化学平衡向正反应方向移动的是 (填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入l mol CO2和4 mol H2
(3)CO2溶于水生成碳酸。已知下列数据:
| 弱电解质 |
H2CO3 |
NH3.H2O |
| 电离平衡常数( 25℃) |
Ka1 = 4.30 × 10一7 Ka2= 5.61× 10一11 |
Kb = 1.77× 10一5 |
现有常温下1 mol·L-1的( NH4)2CO3溶液,已知: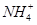 水解的平衡常数Kh=Kw/Kb,
水解的平衡常数Kh=Kw/Kb,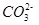
第一步水解的平衡常数Kh=Kw/Ka2。
①判断该溶液呈 (填“酸”、“中”、 “碱”)性,写出该溶液中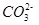 发生第一步水解的离子方程式 。
发生第一步水解的离子方程式 。
②下列粒子之间的关系式,其中正确的是 。
A.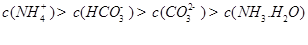
B.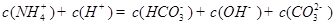
C.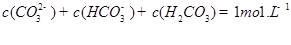
D.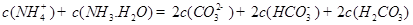
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以CO和O2为原料做成电池。原理如图所示:通入CO的管口是 (填“c”或“d”),写出该电极的电极反应式: 。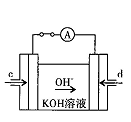
下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清石灰水变浑浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。
请回答下列问题:
(1)C的电子式为;
(2)检验溶液L中金属阳离子的方法是;
(3)反应③的离子方程式为;
(4)F和G的浓溶液反应的化学方程式为;
(5)气体A的密度为2.68g/L(标准状况),通过计算、推理,可确定A的分子式为。
有A、B、C、D、E五种化合物,其中A、B、C、D是含铝元素的化合物,F是一种气体,标准状况下相对于空气的密度为1.103。它们之间有下列的转化关系:
①A+NaOH→D+H2O②B→A+ H2O③C+ NaOH→B+NaCl④E+ H2O→NaOH+F
⑴写出A、B、C、D的化学式:
A,B,C,D。
⑵写出①④的离子方程式:
①,
④
(6分).反应2KMnO4+16HCl===2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是,还原剂是,若生成71gCl2,被氧化的HCl是g。
.下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4500ml的操作,请按要求填空:
(1)所需浓H2SO4的体积为m l
l
(2)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(偏高、偏低、无影响)。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的里,并不断搅拌,目的是。
(4)将的上述溶液沿注入中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要中 ,并摇匀。
,并摇匀。
(8分)(1)3.01×1022个OH-的物质的量为质量为,这些OH-与mol NH3的质量相等,与g Na+含有的离子数相同;
⑵将4.6 g 金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与水反应能够放出标准状
金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与水反应能够放出标准状
况下的气体L,实验后所得溶液中Na+的物质的量为;
⑶同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量之比为原子个数之比。