二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1="a" kJ·mol-1
NH2CO2NH4(s) △H1="a" kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
请回答下列问题:
(1)反应Ⅰ的△H1=__________kJ·mol-1(用具体数据表示)。
(2)反应Ⅱ的△S______(填>或<)0,一般在__________情况下有利于该反应的进行。
(3)反应Ⅲ中影响CO2平衡转化率的因素很多,下图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是________(填提高或降低)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是__________。

(4)反应Ⅰ的平衡常数表达式K1=____________________;如果起始温度相同,反应Ⅰ由在恒温容器进行改为在绝热(与外界没有热量交换)容器中进行,平衡常数K1将__________(填增大、减少、不变)。
(5)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如上图2所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(6)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3。下列物质中与尿素有类似性质的是______。
(NH4)2CO3。下列物质中与尿素有类似性质的是______。
| A.NH2COONH4 | B.H2NOCCH2CH2CONH2 |
| C.HOCH2CH2OH | D.HOCH2CH2NH2 |
弱电解质的电离平衡、盐类的水解平衡和难溶物的沉淀溶解平衡均属于化学平衡。
I、已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
⑴Na2A溶液显碱性的原因(用离子方程式回答)。
⑵某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是。
A.c(H+)·c(OH-)=1×10―14B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)D.c(Na+)+c(K+)=0.05 mol/L
⑶已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq)△H>0。
Ca2+(aq)+A2-(aq)△H>0。
①降低温度时,Ksp(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)。
II、⑷已知常温下Mg(OH)2在pH=12的NaOH溶液中Mg2+的浓度为1.8×10-7mol/L,则 Ksp[Mg(OH)2]=。
X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图17所示;X、Y元素具有相同的最高正化合价;Z元素是形成化合物种类最多的元素。回答下列问题: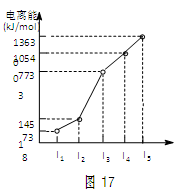
(1)已知Y元素的电负性为1.2,氮元素的电负性为3.0,则Y与氮形成的化合物的化学式为,该化合物的晶体类型为
(2)电负性:X ______Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的化工原料。有关Z2H4分子的说法正确的是__________(填字母)。
| A.分子中含有氢键 |
| B.分子中既含有极性键又含有非极性键 |
| C.含有4个σ键和1个π键 |
| D.属于非极性分子 |
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构示意图如图18所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心)。该晶体中,钛离子和周围________(填数字)个氧离子相紧邻。
(5)X的氧化物的熔点比Y的氧化物的熔点(填“高”或“低”),
原因是。
X、Y、Z、W、Q 五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子外围电子排布式为nsnnp2n,W原子核外的M层中只有两对成对电子,Q的核电荷数是Z与W的核电荷数之和。请回答下列问题:
(1)X、W的元素符号依次为、;
(2)写出Y2的电子式____________________;
(3)WZ2与XZ2分子的空间结构分别是和,相同条件下两者在水中的溶解度较大的是(写分子式);
(4)Q在元素周期表区(填s、p、d、ds、f),其外围电子排布式为,在形成化合物时它的最高化合价为。
(1)氮元素基态原子核外未成对电子数为个;
(2)C、N、O三种元素第一电离能从大到小的顺序是_____________;
(3)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个顶点,该晶体中 X、Y、Z的粒子个数比为______________;
(4)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态
电子排布式;葡萄糖分子中碳原子杂化方式有。
(5)某化合物其组成可用CoCl3·5NH3表示。把CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl。请写出表示此配合物结构的化学式(钴的配位数为6)_____________________。
现有下列物质, 用编号填空回答下列各问题:
| A.干冰 | B.金刚石 | C.氩 | D.过氧化钠 E.二氧化硅 F.氯化铵 |
(1)通过非极性键形成的晶体是 。
(2)固态时属于分子晶体的是 。
(3)由原子构成的分子晶体是 。
(4)含有非极性键的离子化合物是 。
(5)含有离子键、共价键、配位键的化合物是 。