废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下: 
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| |
Fe3+ |
Fe2+ |
Zn2+ |
| 开始沉淀的pH |
1.1 |
5.8 |
5.9 |
| 沉淀完全的pH |
3.0 |
8.8 |
8.9 |
请回答下列问题:
(1)试剂X可能是__________,其作用是____________________。
(2)加入ZnO调节pH=3~4的目的是____________________。
(3)由不溶物生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
(5)下列试剂可作为Y试剂的是______。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:
2Cu2++4I- 2CuI(白色)↓+I2,I2+2S2O32-
2CuI(白色)↓+I2,I2+2S2O32- 2I-+S4O62-
2I-+S4O62-
①胆矾晶体的纯度为_______________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会__________(填“偏高”、“偏低”或“不变”)。
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙丁戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物
和
,0.1
的
溶液
;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐,
也能与
的水溶液反应生成盐;丙、戊可组成化合物
。
请回答下列问题
(1)戊离子的结构示意图为。
(2)与出乙的单质的电子式:。
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2 :4,反应中被氧化的物质与被还原的物质的物质的量之比为。
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:。
(5)按右图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是。
第三主族元素包括B、Al、Ga、In、Tl。
(1)在硼酸B(OH)3分子中,B原子与3个羟基相连,其晶体为层状结构。则分子中B原子杂化轨道的类型为,同层分子间的主要作用为。
(2)氯化铝在气态中常以二聚分子Al2Cl6形式存在,在Al2Cl6分子中存在的化学键的类型有 、。
(3)砷化镓属于第三代半导体,它能直接将电能转化为光能,其晶胞结构如右图所示。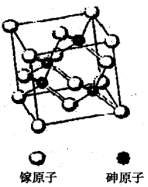
①Ga的基态原子的核外电子排布式为。
②在砷化镓的晶胞结构中,镓原子的配位数为____。
③在砷化镓的晶胞结构中,与同一砷原子相连的镓原子构成的空间构型为。
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子。该厂拟定如图所示的废水处理流程。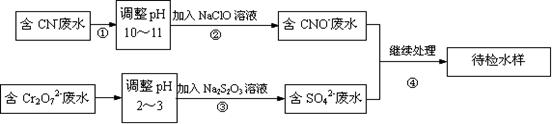
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是。
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因 。
。
(3)②中反应后无气体放出,该反应的离子方程式为。
(4)③中反应时,每0.4 molCr2O72-转移2.4 mol的电子,该反应的离子方程式为。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。请你使用化学用语,结合必要的文字解释其原因。
2011年3月12日,日本因大地震导致福岛核泄漏,主要泄漏物为碘131和绝137。在被辐射地区,每天服用一片碘片可以起到一定的预防作用。因此世界多地出现市民抢购碘片现象,我国部分地区还出现抢购加碘食盐现象。为此卫生部有关专家指出市民不应擅自服用碘片,多吃碘盐也起不到预防放射性碘辐射的作用,且我国碘盐丰富,不必抢购。
碘片和碘盐相关信息:
碘片:主要成分是碘化钾,每片含100毫克的碘,防核辐射每天服一片。
碘盐:加碘食盐,主要成分是氯化钠、碘酸钾,每公斤食用盐中碘含量为20—30毫克。
KIO3可用电解法制得:以石墨为阳极,不锈钢为阴极,在一定温度和电流下电解KI溶液,总反应方程式为:KI+3H2O KIO3 +3H2↑。
KIO3 +3H2↑。
Na2S2O3可与I2反应:I2+2S2O2-3(无色)→2I—+ S4O2-6(无色)。
回答下列问题:
(1)碘化钾、碘酸钾中的碘是碘127,则碘127和碘131的原子结构中不相同的是;以每公斤食用盐中碘含量为20毫克计,人每天吃____公斤盐才相当于服用一片碘片。说明靠吃碘盐来预防放射性碘(填“有”、“无”)作用。
(2)电解法制KIO3中,阳极的电极反应式为____;阴极附近pH值(填“增大”、“减小”、“不变”)。
(3)为防止不法商贩乘机销售假冒加碘食盐,有关部门加强了检测。下面是对某超市出售的加碘精制盐的检测过程:
①取该食盐样品100.0 g加入适量的蒸馏水,振荡使固体完全溶解,然后加入用盐酸酸化的淀粉- KI溶液,结果溶液呈蓝色,有关反应的离子方程式为;
②用0.010mol·L—1的Na2SO3溶液滴定,当用去Na2S2O3溶液12.00mL时蓝色刚好褪去,该加碘食盐中KIO3的含量为mg/kg。由此可判定该食盐为(填“合格”或“不合格”)产品。
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示(部分反应条件略去)。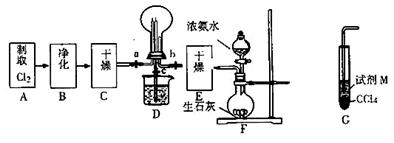
请回答下列问题:
(1)Z元素的原子结构示意图为。
(2)A的电子式为,D的化学式为。
(3)E通过反应可以生成C(填序号,有一个或多个选项符合题意)。
a.分解 b.复分解 c.氧化还原 d.置换
(4)写出下列反应的化学方程式:①,③。
(5)A和E化合生成G,Z2Y是一种麻醉剂,由G在210℃分解生成,该分解反应的化学方程式为。