Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2 Li+2SO2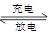 Li2S2O4。下列说法正确的是 ( )
Li2S2O4。下列说法正确的是 ( )
| A.该电池反应为可逆反应 |
| B.放电时,Li+向负极移动 |
| C.充电时,阴极反应式为Li++e-=Li |
| D.该电池的电解质溶液可以换成LiBr的水溶液 |
关于某无色溶液中所含离子的鉴别,下列判断正确的是
| A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在 |
| B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定SO42-存在 |
| C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在 |
| D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32- |
下列溶液中氯离子的物质的量浓度与50mL1mol·L-1氯化铝溶液中氯离子的物质的量浓度相等的是
| A.150mL1mol·L-1氯化钠溶液 | B.75mL2mol·L-1氯化铵溶液 |
| C.150mL3mol·L-1氯化钾溶液 | D.50 mL3mol·L-1氯化亚铁溶液 |
某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:
①H2②Cl2③CH4④HCl⑤NH3⑥NO⑦NO2⑧SO2,
下列操作正确的是
| A.烧瓶是干燥的,由A进气收集①③⑤ |
| B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧ |
| C.在烧瓶中充满水,由A进气收集①③⑤⑦ |
| D.在烧瓶中充满水,由B进气收集⑥ |
下列各项与氧化还原反应无关的是
| A.明矾净化水 | B.燃烧 | C.臭氧消毒游泳池 | D.食物的腐败 |
清蒸大闸蟹由青色变成红色,一同学认为这种红色物质可能象酸碱指示剂一样,遇到酸或碱颜色会发生改变。就这位同学的看法而言,这应该属于科学探究中的
| A.实验 | B.假设 | C.观察 | D.分类 |