甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为_____________________;
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是________;
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解);
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
(经典回放)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。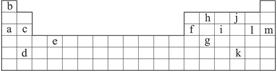
(1)下列____________(填写编号)组成元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、i ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力
B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 |
X |
Y |
|
| 失去第一个电子 |
519 |
502 |
580 |
| 失去第二个电子 |
7 296 |
4 570 |
1 820 |
| 失去第三个电子 |
11 799 |
6 920 |
2 750 |
| 失去第四个电子 |
9 550 |
11 600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第2个电子所需的能量远远大于失去第1个电子所需的能量。_____________________________。
②表中X可能为以上13种元素中的_______________ (填写字母)元素。用元素符号表示X和j形成化合物的化学式:__________________。
③Y是周期表中_______________族元素。
④以上13种元素中,_______________(填写字母)元素原子失去核外第一个电子需要的能量最多。
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并完成下列问题: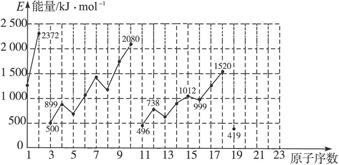
(1)同主族内不同元素的E值变化的特点是________________________________________,各主族中E值的这种变化特点体现了元素性质的________________规律。
(2)同周期内随原子序数的增大,E值增大。但个别元素的E值出现反常现象,试预测下列关系中正确的是____________(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:_________<E<_________。
(4)10号元素E值较大的原因是_________________________________________________。
周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1∶2。写出这些化合物的化学式
___________________________。
下表是元素周期表的一部分,完成下列有关问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
11 |
12 |
(1)写出下列元素符号:①________________,⑥________________,⑦________________。
(2)在这些元素中,最活泼的金属元素是________________,最活泼的非金属元素是________________,最不活泼的元素是________________。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________________,碱性最强的是________________,呈两性的氢氧化物是________________,写出三者之间相互反应的化学方程式。
(4)在这些元素中,原子半径最小的是________________,原子半径最大的是________________。
(5)在③与④中,化学性质较活泼的是________________,怎样用化学实验证明?答:________________________________________________________________。
在⑧与12中,化学性质较活泼的是________________,怎样用化学实验证明?答:________________________________________________________________。
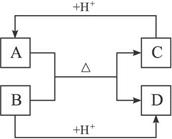
(6分)已知:A、B、C、D分别是中学化学中常见的四种不同粒子,它们之间有如下的反应关系:
(1)如果A、B、C、D均是10电子粒子,请写出:A的化学式______________。
(2)如果A和C是18电子的粒子,B和D是10电子粒子,请写出:
①A与B在溶液中反应的离子方程式:_________________________________________。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示):______________>______________。