已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是 ( )
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)= mol·L-1 mol·L-1 |
| D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) |
下列关系正确的是()
| A.熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 |
| B.密度:CCl4>H2O>苯 |
| C.同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷 |
| D.同物质的量物质燃烧耗O2量:己烷>环己烷>苯>苯甲酸 |
有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平。A、B、C、D、E有下图所示的关系。则下列推断不正确的是( )
A.A→B属于加成反应
B.B、D均能与金属钠反应
C.物质C的结构简式为CH3CHO
D.生成E的化学方程式为:CH3CH2OH+CH3COOH CH3COOC2H5
CH3COOC2H5
有下列高分子化合物:
①
②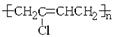
③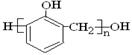
④
⑤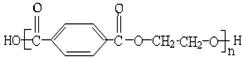
其中由两种不同单体聚合成的是( )
| A.③⑤ | B.③④⑤ | C.①②③⑤ | D.②③④⑤ |
下列实验装置能达到实验目的的是(夹持仪器未画出)
| A.①装置用于检验1-溴丙烷消去产物 | B.②装置用于石油的分馏 |
| C.③装置用于实验室制硝基苯 | D.④装置可证明酸性:盐酸>碳酸>苯酚 |
我校即将进行寒假实践活动,某同学用化学知识解决生活中的问题不合理的是
| A.用食醋除去暖水瓶中的水垢 |
| B.用米汤检验食盐中是否含碘酸钾 |
| C.用热的纯碱溶液洗涤餐具上的油 |
| D.用灼烧并闻气味的方法区别纯棉和纯羊毛织物 |