蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量[约在14%~18%(本题涉及的含量均为质量分数)],故食品中蛋白质的含量测定常用凯氏定氮法。其测定原理是:
Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4作用下,生成一种无机含氮化合物,反应式为:2—NH2+H2SO4+2H+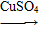 ________。
________。
Ⅱ.该无机化合物在凯氏定氮器中与碱作用,通过蒸馏释放出NH3,收集于H3BO3溶液中,生成(NH4)2B4O7。
Ⅲ.用已知浓度的盐酸标准溶液滴定,根据盐酸的消耗量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
(1)上述原理第Ⅰ步生成的无机含氮化合物化学式为________。
(2)乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。不法分子通过在低蛋白含量的奶粉中加入三聚氰胺(Melamine)来“提高”奶粉中的蛋白质含量,导致许多婴幼儿患肾结石。
①三聚氰胺的结构如图所示,其化学式为________,含氮量(氮元素的质量分数)为________;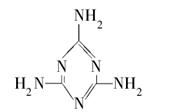
②下列关于三聚氰胺的说法中,正确的有________
A.三聚氰胺是一种白色结晶粉末,没有什么气味和味道,所以掺入奶粉后不易被发现
B.三聚氰胺分子中所有原子可能在同一个平面上
C.三聚氰胺呈弱碱性,可以和酸反应生成相应的盐
③假定奶粉中蛋白质的含量为16%即为合格,不法分子在一罐总质量为500 g、蛋白质含量为0的假奶粉中掺入多少克的三聚氰胺就可使奶粉“达标”?
现有A、B两种链状饱和一元醇的混合物0.3 mol,其质量为13.8g。已知①A和B碳原子数均不大于4,且A<B;②A和B分子中均不含有支链,且都能被催化氧化生成醛。
(1)混合物中A可能的分子式;B可能的分子式。
(2)若n(A):n(B)=1:1时,A的名称B的名称。
(3)若n(A):n(B)≠1:1时,A的结构简式为;
B的结构简式为。则n(A)∶n(B) =。
按以下步骤可从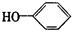 合成
合成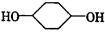 (部分试剂和反应条件已去).
(部分试剂和反应条件已去).
请回答下列问题:
(1)B、F的结构简式为:BF。
(2)反应①~⑦中属于消去反应的是(填代号)。
(3)根据反应 ,写出在同样条件下
,写出在同样条件下
CH2=CH—CH=CH2与等物质的量 发生加成反应的化学方程式:
发生加成反应的化学方程式:
。
(4)写出第④步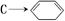 的化学方程式(有机物写结构简式,注明反应条件).
的化学方程式(有机物写结构简式,注明反应条件).
。
(5)A—G这七种有机物分子中含有手性碳原子的是(填序号) 。
(6)核磁共振谱是测定有机物分子结构最有用的工具之一。在有机物分子中,不同位置的氢原子在质子核磁共振谱(PMR)中给出的峰值(信号)也不同,根据峰(信号)可以确定有机物分子中氢原子的种类和数目。例如:乙醛的结构式为: ,其PMR谱中有2个信号峰,其强度之比为3∶1。则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1∶1∶2的是。
,其PMR谱中有2个信号峰,其强度之比为3∶1。则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1∶1∶2的是。
A.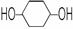 B.
B.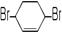 C.
C. D.
D.
(8分)按要求完成下列问题
(1)甲基的电子式________ _____
(2)通式为CnH2n+2的最简单同系物的分子式
(3)相对分子质量为72且沸点最低的烷烃的结构简式___________________
(4)1、3-丁二烯的键线式
(4分)下列叙述正确的是________________(选对一个给2分,多选、错选一个扣1分,本题不出现负分)。
| A.不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗。 |
| B.甲、乙两种有机物具有相同的相对分子质量和不同结构,则甲和乙一定是同分异构体。 |
| C.浓溴水滴入苯酚溶液中立即产生2,4,6-三溴苯酚的白色沉淀。 |
| D.溴的苯溶液中加少量铁粉后会剧烈反应,并放出大量的热,但该现象不能说明苯和溴的取代反应就是放热反应。 |
E.分离沸点相差30℃以上的混溶液体,应采用的方法是分馏
F.实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃。
G.除去混在苯中的少量苯酚,加入过量溴水,过滤。
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是。
(2)B→C的反应类型是。
(3)E的结构简式是。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
。
(5)下列关于G的说法正确的是。
a.能与溴单质反应 b.能与金属钠反应
c.1molG最多能和3mol氢气反应 d.分子式是C9H6O3