某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积KW= 。在此温度下,将 pH = a的 NaOH 溶液 Va L 与 pH = b的 H2SO4溶液 Vb L 混合。
(1)若所得混合液为中性,且 a= 12,b= 2,则 Va∶Vb= ;
(2)若所得混合液为中性,且 a+ b= 12,则 Va∶Vb= ;
(3)若所得混合液的 pH = 10,且 a= 12,b= 2,则 Va∶Vb= 。
(16分)某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:
已知:
①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-:
②)TiOSO4水解的反应为:TiOSO4+(x+1)H2O=TiO2∙xH2O↓+H2SO4
请回答:
(1)步骤①所得滤渣的主要成分为__________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比_______。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是______________________。
(5)已知:FeCO3(s)  Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________。
(19分)(1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知:H2S(g)  H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。ΔH_____0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因:________________________。
②电化学法:该法制氢过程的示意图如图。
反应池中反应的离子方程式是_____________________________;
反应后的溶液进入电解池,电解总反应的离子方程式为___________________________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式__________________。②电池总反应的化学方程式__________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KMnO4溶液进行滴定,实验所得数据如下表所示;
| 滴定次数 |
1 |
2 |
3 |
4 |
| KMnO4溶液的体积/ml |
20.60 |
20.02 |
20.00 |
19.98 |
①滴入最后一滴酸性KMnO4溶液,溶液___________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗;
B.锥形瓶洗净后未干燥;
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。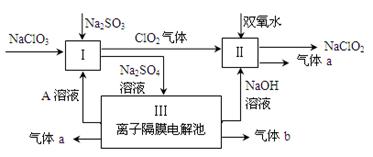
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是、(填化学式)。
(2)Ⅱ中反应的离子方程式是。
(3)A的化学式是,装置Ⅲ中A在极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量。(填“相同”,“不同”或“无法判断”)
A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式),E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)。
(2)由L、I两元素可按原子个数比1:l组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为。
(3)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式。
(4)由A、B、C、D按原子个数比4:1:1:2形成一种化合物Y,则Y的化学式为,向Y中加足量稀硫酸后,再加高锰酸钾溶液,可使酸性高锰酸钾溶液褪色,写出使酸性高锰酸钾溶液褪色的离子方程式。
(9分)氮及其化合物在很多方面有重要的用途。
(1)氮的氧化物有多种。现有NO和NO2的混合气体,其中N 、O元素质量之比为7:12,则该混合气中NO和NO2的物质的量之比为 。
(2)氨气的实验室制法有多种,若不加热,制取氨气所用试剂可以用浓氨水和生石灰,产生氨气的原因是:;氨气的检验方法是:。
(3)硝酸具有很强的氧化性,王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属。铂溶于王水时产生[PtCl6]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式。
(4)氮的一种氢化物肼(即N2H4)用作发射卫星的燃料。
已知: N2 + 2O2 = 2NO2 N2H4 + O2 = N2 + 2H2O
发射卫星用气体肼为原料,以NO2为氧化剂,两种物质反应生成氮气和水蒸气,反应中每有4mol电子转移,则生成N2质量为g。