铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
3FeS2+8O2 6SO2+Fe3O4,该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
6SO2+Fe3O4,该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
(2)氯化铁溶液显酸性,原因是___________________________(离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:___________________________。
(3)K2FeO4可作为一种“绿色高效多功能”水处理剂。原因是 。目前,人们针对K2FeO4的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物K2FeO4水溶液稳定性的是
| A.亚硫酸钠 | B.KOH | C.醋酸 | D.Fe(NO3)3 |
(4)K2FeO4与Zn组成新型二次电池高铁电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH  3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
放电时电池的负极反应式为_______;充电时电解液的pH________(填“增大”“减小”或“不变”之一)。
在下列物质中属于同一种物质的有、;互为同分异构体的有、。
(1)液氯 (2)氯气 (3)白磷 (4)红磷 (5)D (6)T
(7) 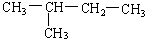 (8)
(8) 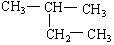 (9)新戊烷
(9)新戊烷
(1)下列物质都能与Na反应放出H2: ①C2H5OH ②CH3COOH溶液 ③NaOH溶液,产生H2的速率由大到小的次序是(填序号)
(2)某气态烃1体积只能与1体积氯气发生加成反应生成氯代烷,此氯代烷1mol可与4mol氯气生
完全的取代反应,则该烃的结构简式为
(3)常温常压下CH4和C2H6混合后平均组成为C1.5H5,则二者的体积比为。若平均组成为C1.2H4.4
则二者的体积比为。
已知过氧化钠 投入水中能发生下列反应:2Na2O2+2H2O==4NaOH+O2↑。现将7.8g过氧化钠投入水中,充分反应后。计算:
(1)求生成的氢氧化钠的物质的量和氧气的体积。
(2)如反应后得到的溶液中Na+和水分子的个数比为1︰100,则开始时所用的水的质量是多少g?
有一种氯化钠与氯化钾的混合物,它所含钾与钠的物质的量之比为3∶1,求:
(1)混合物中氯化钾的质 量分数。
(2)含1 mol Cl-的混合物的质量。
Ⅰ.现有标准状况下的以下物质:
| A.11.2LO2 | B.6.8gNH3 | C.1.204×1024CH4 | D.0.5molCO2; |
其中质量由大到小的顺序为,
各物质所含原子数由大到小的顺序是,
其体积由大到小的顺序是,
气体的密度由大到小的顺序是。(填序号)
Ⅱ.相同质量的CO和CO2,其物质的量之比为,所含的氧原子个数比为,所含碳元素的质量比为,相同条件下的体积比为。