化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:________。
(2)实验中,需加热至恒重的目的是________。
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3—=BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为________。
(2)实验中判断沉淀是否完全的方法是________。
方案三:按如下图所示装置进行实验:
(1)D装置的作用是________。分液漏斗中________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90 g样品,实验后测得C装置增重8.80 g,则样品中Na2CO3的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷,该缺陷是________。
(10分) (1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol/L的盐酸溶液30.00mL恰好中和完全(如图所示)。试回答:
①甲、乙、丙三套装置共有________处错误。
②丙的操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是。
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及其质量填表如下:(表格可不填满也可补充)
| 成分 |
|||
| 质量/g |
(2)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度___ __(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
__(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
某课外活动小组设计了以下实验方案探究Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
(1)测定NO的体积
①从上图所示的装置中,你认为应选用装置进行Ag与浓硝酸反应实验
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是3→ (填各导管口编号)。
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(2)测定硝酸的物质的量:反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,第一次滴定前后的滴定管中液面的位置如图所示。请将读数填到表格的相应位置
| 滴定前读读数/mL |
滴定后读数/mL |
|
| 第一次 |
||
| 第二次 |
0.10 |
18.00 |
| 第三次 |
0.20 |
18.30 |
依据表格的数据计算出在B容器中生成硝酸的物质的量为mol。
(3)气体成份分析
若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程(填“有”或“没有”)NO产生,作此判断的依据是。
可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),乙管可上下移动。


A BC
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择(填装置序号)。
(2)实验中的气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出。
(3)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是。
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向C装置的乙管中加适量水;
第二。
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为nmol,则用含n和V的式子表示m=(结果可不必化简)。
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。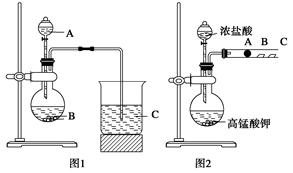
根据图1回答:
(1)写出选用物质的名称:A____________,B__________,C____________;
(2)烧瓶中反应的离子方程式为_______________________________________________
烧杯中反应的离子方程式为_______________________________________________。
根据图2回答:
(3)乙同学的实验原理是_______________________________________________
(4)B处的实验现象是_______________________________________________;
(5)B处的反应的离子方程式: ____________________________________________。
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物物分子式的常用装置。
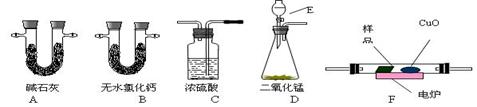
回答下列问题:
(1)现准现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:(1)按上述所给的测量信息,装置的连接顺序应是


 DF;
DF;
(2)A、B管内均盛有有固态试剂,A管的作用是______________________; (3)E中应盛装什么试剂:_______________;
(3)E中应盛装什么试剂:_______________;
(4)如果把CuO网去掉,A管重量将_______;(填“增大”、“减小”、或“不变”)
(5)请改进这套装置的一个不足之处;;
(6)该有 机物的实验式为__________________;
机物的实验式为__________________;
(7)要确定该有机物的分子式,还必须知道的数据是__ _________。
_________。