为验证木炭与浓硫酸反应生成物中有二氧化硫和二氧化碳,选用下图仪器(含所盛物质),组装成套实验装置,试回答下列问题。
(1)在实验进行中,按气流方向从左到右顺序,A、B、C、D各装置的连接应该(用字母符号)是: 。
(2)试管B、C、D中各有什么现象,才能表示已检出二氧化碳、二氧化硫?
B中为 。 C中为 D中为 。
(3)写出A装置中反应化学方程式: 。
工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4、NaCl中的一种或两种杂质。现有工业碳酸钠样品,某化学兴趣小组就工业碳酸钠中是否含有这两种杂质进行探究。 实验室有以下的仪器和药品可供使用:
实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2、0.1 mol·LBa(NO3)2、蒸馏水。以下是部分实验探究过程:
1)提出假设:
假设1白色粉末为 的混合物;
假设2白色粉末为 的混合物;
假设3白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验 请回答:
请回答:
(1)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是 (填“对的”或“错的”),原因是:。
(2)设计实验方案
基于工业碳酸钠中两种杂质均存在这一假设,设计出实验方案(在答题卡上作答)。
| 编号 |
实验操作 |
预期现象和结论 |
| ① |
  |
有无色气体产生,说明样品中含有Na2CO3。 若无气体产生,说明样品中没有Na2CO3。 |
| ② |
  |
|
| ③ |
  |
已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4。三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某化学兴趣小组通过实验来探究某红色粉末是Fe2O3或Cu2O或两者的混合物。(实验所需试剂只能从下列中选择:稀硫酸、KSCN溶液、稀硝酸、双氧水、铁粉、碱式碳酸铜)
探究方案:将红色粉末溶于足量的稀硫酸中;实验现象:反应后有红色固体存在;
(1)结论:红色粉末是。
(2)如果红色粉末是Cu2O和少量Fe2O3的混合物,请设计实验证明之。
实验操作:
实验现象:
(3)兴趣小组欲利用Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知:在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀的pH |
6.4 |
9.7 |
1.9 |
| 沉淀完全的pH |
9.6 |
12.7 |
3.7 |
实验小组设计如下实验方案: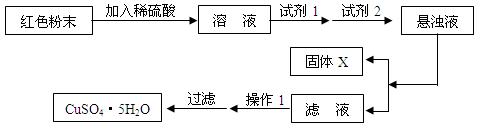
试回答:
①试剂1为,试剂2为(填名称);
加入试剂1后发生反应的离子方程式为________________________,_______________________。
②固体X的化学式为;
③操作1为。
亚铁是血红蛋白重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种常见补药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸:与Vc(维生素C)同服可增加本品吸收。
(一)甲同学设计了以下下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用: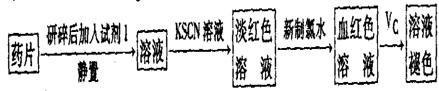
(1)加入新制氯水后溶液中发生的离子反应方程式是_________、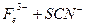
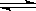
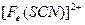 。
。
(2)加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+。该离子存在的原因可能是(填编号)_____________________。
A.药品中的铁本来就应该以三价铁的形式存在
B.在制药过程中生成少量三价铁
C.药品储存过程中有少量三价铁生成
(3)向血红色溶液中加入一片Vc片,片刻后溶液血红色褪去,说明Vc有_______性;药品说明书中”与Vc同服可增加本品吸收”请说明理由_______________________。
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为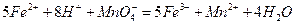 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(4)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是______(填序号)。
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
(5)本实验滴定过程中操作滴定管的图示正确的是_______(填编号)。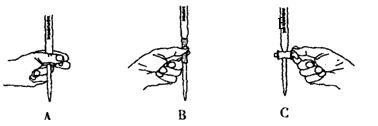
(6)请通过计算,说明该药品含“铁”量是否合格(写出主要计算过程)?
已知实验室制取H2S的实验原理为FeS(块状)+H2SO4===FeSO4+H2S↑。根据下图中A~D 的实验装置和试剂进行实验:
(1)装置A是由双孔塞、玻璃导管、________和________组装起来的。
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性: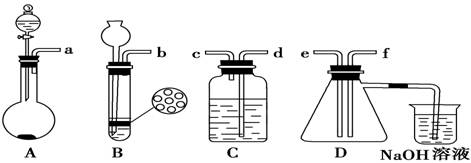
制备SO2的实验原理:Na2SO3(粉末状)+H2SO4(70%)===Na2SO4+SO2↑+H2O。
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是___________。
②C装置中的溶液是 ,说明二氧化硫具有 性。
(3)D中产生的现象是 ,说明二氧化硫具有 性。
(4)烧杯中发生反应的离子方程式为________________________。
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2两种盐的溶解度(单位为g/100g水)
| 温度 / ℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下: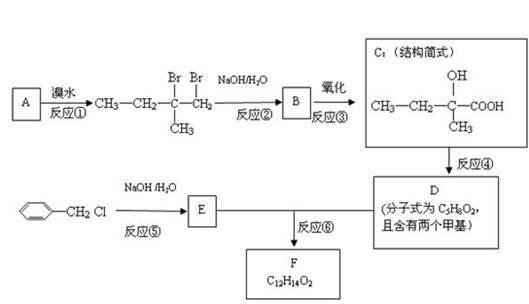
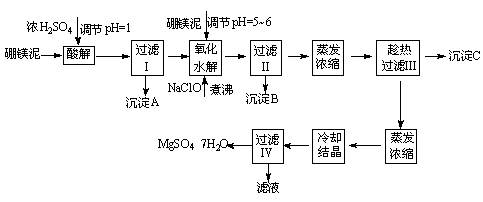
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为。加热煮沸的主要目的是_。 (2)沉淀B中除MnO2、SiO2外还含有(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是;
(4)沉淀C的化学式是。过滤III需趁热过滤的理由是。