在下列实验中,不能达到目的的是 ( )
| A.Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS,确定非金属性:Cl>S |
| B.用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱 |
| C.进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 |
| D.用pH试纸测定氯水的酸碱性 |
100 mL 98%的浓硫酸(ρ=1.84 g·mL-1)的物质的量浓度是…………………
A. mol/L mol/L |
B.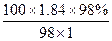 mol/L mol/L |
C.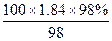 mol/L mol/L |
D.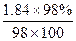 mol/L mol/L |
已知I-、Fe2+、SO2、Cl-、和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
| A.2Fe 3+ + SO2 + 2H2O = 2 Fe 2+ + SO42- + 4H+ |
| B.I2 + SO2 + 2H2O= H2SO4 + 2HI |
| C.2 Fe 2+ + I2=2Fe 3+ + 2I- |
| D.H2O2 + SO2=H2SO4 |
使相同体积的NaCl、MgCl2、AlCl3溶液中Cl-完全沉淀,若用去0.2mol/L 的AgNO3溶液的体积相等,则上述三溶液溶质的物质的量浓度之比为
| A.6:3:2 | B.3:2:1 | C.1:2:3 | D.1:1:1 |
离子反应方程式H++OH—=H2O,可表示的化学反应是
| A.Cu(OH)2和稀H2SO4反应 | B.HNO3和Mg(OH)2反应 |
| C.Ba(OH)2溶液和HCl溶液混合 | D.NaOH和CH3COOH反应 |
除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液。下列正确的操作顺序是:
| A.①④②⑤③ | B.②⑤④①③ | C.⑤②①④③ | D.④①②⑤③ |