Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1,3,6,6,且都含有18个电子,B、C由两种元素的原子组成,且分子中两种原子的个数比均为1:2,D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是________。
(2)从B分子的立体结构判断,该分子属于________分子(填“极性”或“非极性”)。
(3)1个C分子中包含________个σ键。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):________。
Ⅱ.CO的结构可表示为CO,N2的结构可表示为NN。
(5)下表是两者的键能数据(单位:kJ·mol-1):
| |
A—B |
A=B |
A≡B |
| CO |
357.7 |
798.9 |
1071.9 |
| N2 |
154.9 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因:________。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为________,基态Cu原子的价电子排布式为________。
(7)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型)。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。 (1)冶炼铜的反应为
(1)冶炼铜的反应为




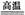 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2 若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。 (2)上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。 a.高空排放 b.用于制备硫酸
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收 (3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
 S2O
S2O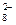 +2I- 2SO
+2I- 2SO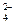 +I2
+I2 通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程: 、 (不必配平)。
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程: 、 (不必配平)。 (4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为: ①用稀盐酸浸取炉渣,过滤。
①用稀盐酸浸取炉渣,过滤。 ②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。 据以上信息回答下列问题:
据以上信息回答下列问题: a.除去Al3+的离子方程式是 。
a.除去Al3+的离子方程式是 。 b.选用提供的试剂,设计实验验证炉渣中含有FeO。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。 提供的试剂:稀盐酸稀硫酸 KSCN溶液酸性KMnO4溶液 NaOH溶液
提供的试剂:稀盐酸稀硫酸 KSCN溶液酸性KMnO4溶液 NaOH溶液 碘水
碘水 所选试剂为 。
所选试剂为 。 证明炉渣中含有FeO的实验现象为 。
证明炉渣中含有FeO的实验现象为 。
铜在自然界存在于多种矿石中,如:



| 矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
| 主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题: (1)上表所列铜化合物中,铜的质量百分含量最高的是
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
。
 (2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。 (3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。 (4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理: 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理: 。 (5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铜绿的主要成分是碱式碳酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
| B |
铜表面易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
| C |
铁比铜活泼 |
铆在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
| D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂 等。
等。



 (1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。 (2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。 正极反应 负投反应 。
正极反应 负投反应 。 (3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Fe2+ Cu2+ Cu2+ |
1.9 7.0 7.0 4.7 4.7 |
3.2 9.0 9.0 6.7 6.7 |
| 提供的药品:Cl2浓H2SO4 NaOH溶液 CuO Cu |
||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。 有关反应的化学方程式
有关反应的化学方程式  劣质不锈钢腐蚀的实验现象
劣质不锈钢腐蚀的实验现象
铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入10mL 6mol·L-1HNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题: (1)写出Cu2O跟稀硝酸反应的化学反应方程式____________ 。(不必配平)
(1)写出Cu2O跟稀硝酸反应的化学反应方程式____________ 。(不必配平) (2)产物中硝酸铜的物质的量______________mol;
(2)产物中硝酸铜的物质的量______________mol; (3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol (4)如混合物中Cu的物质的量为x,求x的取值范围________________。
(4)如混合物中Cu的物质的量为x,求x的取值范围________________。
氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.





 ↓蒸发结晶
↓蒸发结晶 CuCl2·2H2O(纯)
CuCl2·2H2O(纯) (1)加入氧化剂X的目的是
(1)加入氧化剂X的目的是 (2)下列氧化剂中最适合本实验的是
(2)下列氧化剂中最适合本实验的是
| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
 (3)物质Y和沉淀Z的化学式分别是 和 .
(3)物质Y和沉淀Z的化学式分别是 和 . (已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)
(已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)