A、B、C、D、E、F六种元素的原子序数依次递增。
已知:①F的原子序数为25,其余的均为短周期元素;②元素A与元素B同周期,元素A与元素E同主族,且A、B、E三种原子p轨道上均有2个未成对电子;③元素C、D、E在同一周期,且C原子中没有未成对电子。
请回答下列问题:
(1)元素A与元素B的电负性大小比较为:________>________;元素C与元素D的第一电离能的大小比较为:________>________(填入相应的元素符号)
(2)F的核外电子排布式为________。
(3)元素B与元素E形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(4)由氢元素与A、B两元素共同构成的相对分子质量为30的分子里,中心原子的杂化轨道类型为________,分子的空间构型为________.
(5)根据等电子原理,写出由元素A与元素B构成的一种双原子极性分子的结构式:________。
三氟化氮是一种无色、无味、无毒且不可燃的气体,可在铜的催化作用下由F2和过量NH3反应得到,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO 和 HNO3,请根据要 求回答下列问题:
求回答下列问题:
⑴写出制备NF3的化学反应方程式:。反应过程中,氧化剂与还原剂的物质的量之比为。
⑵写出三氟化氮与水蒸气反应的化学方程式:。⑶NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体
泄漏时的现象是。
⑷一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染。其产物除H2O外,还有另三种
钠盐:(填化学式)。
⑴24 mL 0.05 mol·L-1的Na2SO3溶液恰好被20 mL 0.02 mol·L-1的K2R2O7溶液氧化,则元素R在还原产物中的化合价是________。
⑵将0.64 g Cu全部溶于一定量的浓硝酸中,测得生成气体0.009 mol(含NO、NO2和N2O4),共消耗硝酸0.032 mol。将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O。计算空气中参加反应的O2在标准状况下的体积 为________mL。
为________mL。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为 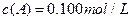 、
、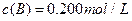 及
及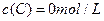 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。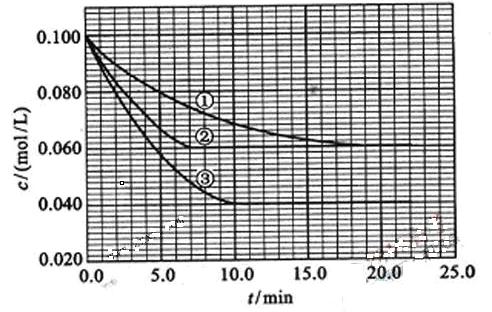
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
② ;
③
(2)实验②平衡时B的转化率为 _________;实验③平衡时C的浓度为____________;
(3)该反应的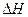 ____
____ _____0,判断其理由是_____________________;
_____0,判断其理由是_____________________;
(4)该反应进行到4.0min时的平均反应速率:
实验②: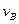 =;
=;
实验③: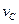 =____________________。
=____________________。
反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是
______ _________。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑;
②Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
⑴反应①中元素被还原,反应②中元素被还原。(填元素符号)
⑵当反应①生成2g H2时,消耗H2SO4的质量是g 。
⑶反应②中生成32g SO2气体时,消耗H2SO4的质量是g ,其中有g H2SO4作为氧化剂被还原。