按要求完成下列内容。
(1)写出下列物质的电离方程式
盐酸
氢氧化钠溶液
氯化钡溶液
碳酸氢钠溶液
(2)写出下列反应的离子方程式
①锌和稀硫酸溶液的反应:
②碳酸钙与稀盐酸的反应:
③氯化铜溶液与氢氧化钠溶液的反应:
(3)写出符合离子方程式Ag++Cl-=AgCl↓的一种化学方程式 。
(12分) 甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) 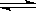 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g) 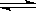 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
②已知反应Ⅰ的能量变化如图所示:由表中数据判断ΔH10 (填“>”、“=”或“<”)。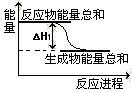
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为________
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。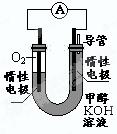
①该电池正极的电极反应为____________
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为____________.
(共13分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1) 在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3) 最高价氧化物是两性氧化物的元素是_________;写出它的氧化物与氢氧化钠反应的离子方程式_____________________________________________。
(4) 用电子式表示元素④与⑥的化合物的形成过程:,该化合物属于(填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式,该化合物是由
(填“极性”“非极性”)键形成的。
(6)写出元素⑦的单质与水反应的离子方程式
12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是,X的相对原子质量是。
过氧化氢(H2O2)有广泛的用途。工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理是:2NH4HSO4 (NH4)2S2O8+H2↑,
(NH4)2S2O8+H2↑,
(NH4)2S2O8+2H2O==2NH4HSO4 + H2O2。其流程如下:
回答下列问题:
(1)根据以上反应原理可知,电解硫酸氢铵溶液时,阴极的电极反应方程式是:
。
(2)在上流程图中,采用减压蒸馏的原因是:。
可循环利用的物质是。
(3)过氧化氢具有的化学性质是。
| A.不稳定性 | B.弱碱性 | C.氧化性 | D.还原性 |
(4)硫酸铜溶液中混有少量硫酸亚铁。在除去杂质的过程中,使用过氧化氢时反应的离子方程式是_________________________________________________。
(5)在硫酸的存在下,用过氧化氢与乙酸作用制备过氧乙酸(CH3COOOH)的化学方程式是:_______________________________________________________。
香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):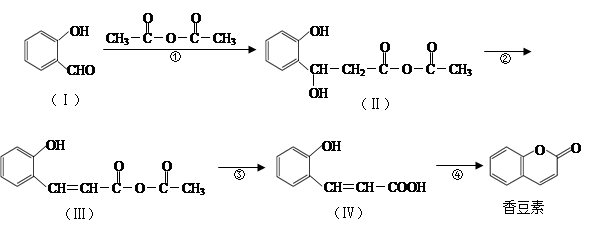
(1)Ⅰ的分子式为_____________;Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为_______ _______。
(2)反应②的反应类型是__________,反应④的反应类型是____________。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为:
_______________。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为_______________(任写一种)。
(5)一定条件下,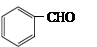 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。