将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:化学变化过程中的平衡状态可以通过改变反应条件而发生变化。对电离平衡、水解平衡、化学平衡等各种平衡移动的方向与外界条件变化的关系请你运用一句话进行总结:______________。
问题2:不同化学反应进行的快慢和程度千差万别。在复杂的反应中,要考虑反应的先后顺序。已知NH4++AlO2-+H2O=Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+、混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中
(1)第二个离子反应的离子方程式是
(2)最后一个离子反应的离子方程式是
问题3:化学反应的复杂性决定了反应方程式计量数的复杂性。对下列化学反应:
8KMnO4+15Kl+17H2SO4→8MnSO4+5I2+5KIO3+9 K2SO4+17H2O
如果该反应方程式中I2和KIO3的系数不是5,可能的配平系数还有许多组。请你再写出一个配平的该反应的化学方程式: 。
问题4:1840年盖斯根据一系列实验事实得出规律:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g):△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g):△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为: 。
某原子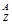 X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
(1)Z值=和A=值;
(2)X元素在周期表中的位置第周期族。
化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)。则:
(1)我们可以通过计算确定A的化学式,其中x=,y=;
(2)已知A分子中x个氧原子呈…—O—O—O—…链状排列,则A分子的电子式是,结构式是。
(1)在1—18号元素中,能形成最稳定气态氢化物的元素是 ;与水或酸反应最剧烈的金属单质是;最高价氧化物的水化物中碱性最强的元素是;最高价氧化物的水化物中酸性最强的元素是。(填写元素符号)
(2)物质在下列变化过程中克服的是:a分子间作用力 b共价键 c离子键(填序号)
①冰融化;
②食盐熔化;
③H2S受热分解成S和H2;
④NaHSO4溶解于水;
(3)共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用的是_________
| A.干冰 | B.氯化钠 | C.氢氧化钠 | D.碘 |
(4)氮化钠是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答,Na3N的电子式是________, Na3N与盐酸反应方程式_____________________________________;
已知:C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ/mol;2H2(g)+O2(g)=2H2O(g);ΔH=-483.6 kJ/mol,现有0.2 mol的炭粉和氢气组成的悬浮气且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为。家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×105kJ,试写出表示丁烷燃烧热的热化学方程式:
25℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是(用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(选填“>”、“<”、或“=”)
(3)求出混合液的下列算式的精确计算结果(填具体数字):
c(Na+)-c (A-)= mol·L-1;
(4)已知NH4A溶液是中性,又知将HA溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7 (选填“>”、“<”或“=”);
(5)将相同温度下浓度相同的四种盐溶液:
| A.NH4HCO3 | B.NH4A | C.(NH4)2SO4 | D.NH4Cl |
按pH由大到小的顺序排列(填序号)