实验室测定含碘废液中I-的含量以及碘的回收过程如下:
Ⅰ.含碘废液中I-含量的测定
用移液管量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入10 mL 2 mol·L-1H2SO4,加入几滴二苯胺磺酸钠(用作指示剂),用0.0250 mol·L-1标准K2Cr2O7溶液进行滴定至终点。重复3次,数据记录如下表:
(已知反应:①2Fe3++2I-=2Fe2++I2 ②6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O)
| 次数 |
1 |
2 |
3 |
| 滴定体积(mL) |
19.60 |
19.65 |
19.55 |
Ⅱ.碘的回收
取250 mL含碘废液于烧杯中加入按上述计算所需的Na2S2O3溶液,并将CuSO4饱和溶液在不断搅拌下滴加到废液中,加热至70℃左右完全反应(已知:2I-+2Cu2++2S2O32-=2CuI↓+S4O62-)。过滤,得到的沉淀按图1进行操作。检查装置的气密性后,从分液漏斗中逐滴加入浓硝酸(注意滴液的速度)完全反应后,通过减压过滤,得到粗碘固体产品和抽滤液。然后按图2进行粗碘的提纯。
回答下列问题:
(1)用移液管量取废液时,将移液管竖直放入稍倾斜的锥形瓶中,接着的操作是______________________________________,数秒后,取出移液管。
(2)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是__________________________。
(3)根据滴定有关数据,该废液中I-含量是________g·L-1。
在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是_____。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
(4)在图1锥形瓶中发生反应的化学方程式是____________________。
(5)按图2装置进行粗碘提纯,采用的分离方法是________,a、b为冷凝水进出口,其中________(选填a或b)接水龙头进水。最终得到较高纯度的单质碘。
实验室里要配制465 mL 0.2 mol/L的硫酸钠溶液。
(1)请填写下列空白:
| A.计算、称量、溶解:在天平上称出________g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。 |
| B.转移:把得到的溶液冷却后小心地沿着________注入________中。 |
| C.洗涤:用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。 |
| D.定容:继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm,改用________小心滴加蒸馏水至溶液凹液面底部与刻度线相切。 |
E.摇匀:将瓶塞塞紧,充分摇匀。
F.贴标签、装试剂瓶:将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(2)下列情况会使所配溶液浓度偏高的是________(填字母)。
a.某同学定容时俯时容量瓶刻度线
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线又加水了
d.进行B操作时将少量液体洒到外面
e.未冷却至室温就进行转移
为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下所示方案进行实验。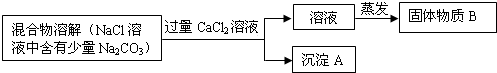
(1)沉淀A的化学式是________。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作过程是___________。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。固体物质B的成分为________(用化学式表示)。
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后加热煮沸。有关反应的化学方程式为______________。
(13分)半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)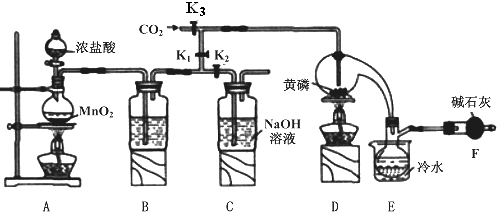
已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。
②PCl3遇水会强烈水解生成H3PO3和HCl;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3。
④PCl3、POCl3的熔沸点如表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为____________。
(2)B中所装试剂是_______;F中碱石灰的作用有两种,分别是______、_______。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是_______。
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为_______。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL。
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应,该产品中PCl3的质量分数为_________。
硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有 。
| A.NaOH溶液 | B.酸性KMnO4溶液 | C.澄清石灰水 | D.盐酸 |
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。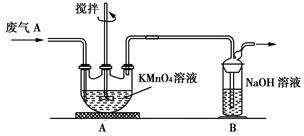
①为了保证实验成功,装置A应具有的现象是 ,搅拌的目的是 。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是 。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4•7H2O)。实验模拟制备皓矾工业流程如下: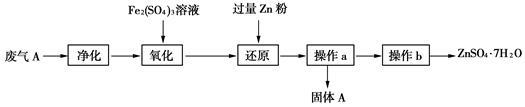
①“氧化”中加入硫酸铁发生反应的离子方程式是 。
②加入Zn粉的目的是 。
③固体A主要成分是 。
④操作b得到纯净皓矾晶体,必要的操作是 、 、过滤、洗涤、干燥。
1000mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
| 阳离子 |
K+、NH4+、Fe3+、Ba2+ |
| 阴离子 |
Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(所加试剂均过量):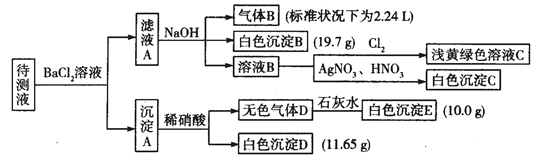
(1)写出生成白色沉淀B的离子方程式:_______________。
(2)待测液中肯定不存在的阳离子是_____________。
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
| 阴离子 |
Cl- |
Br- |
CO32- |
HCO3- |
SO32- |
SO42- |
| 浓度/ mol·L-1 |
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:__________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是__________。
②沉淀A中能还原稀硝酸的成分是________________(写化学式)。