短周期非金属元素A、B、C的核电荷数依次增大,A原子的外围电子排布式为ns2np2,C是地壳中含量最多的元素。元素D、E都位于第四周期,其中E的核电荷数为29,D原子的核外未成对电子数在同周期中是最多的。请用对应的元素符号或化学式填空:
(1)元素A、B、C的第一电离能由小到大的顺序为________。
(2)已知(AB)2分子中键与键之间的夹角为180°,并有对称性,且每个原子的最外层电子数均满足8电子结构,则其结构式为________,1 mol该分子中含有的π键的数目为________。
(3)基态D原子的外围电子排布式为________。化合物DO2Cl2的熔点是-96.5 ℃,沸点是117 ℃,则固态DO2Cl2属于________晶体。
(4)已知元素E的氢化物的晶胞结构如图所示,则其化学式为___________________。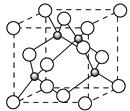
(12分)某工业废水肿含有一定量的Cr2O72-和CrO42-,现
取样该工业废水,检测其中铬的含量。
步骤I:取25. 00 mL废水,加入适后稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,滴人几滴指示剂。
步骤Ⅲ: 用o .1000 mol·L-1Na2S2O3溶液滴定(I2+2Na2 S2O3= 2NaI+Na2S4O6)
达到终点时消耗溶液24. 00 mL。
步骤Ⅳ:将上述反应后的溶液进行如下处理:反应后废液
回答下列问题
(1)步骤I加入稀硫酸酸化的目的是;
(2)步骤Ⅱ中发生如下反应,请完善并配平离子方程式
该步骤中所加指示剂是 ;
(3)步骤Ⅲ判断滴定达到终点的现象是____。
(4)步骤Ⅳ在生产生活中的意义是____(任答一条);
(5)计算工业废水中铬元素的含量是mg/L.
W、X、Y、Z为原于序数依次增大的前四周期元素,其中W、X、Y为主族元素。用X的氧化物漂白的草帽日久又变成黄色;基态W原子有两个单电子,且与X不同周期不同族,X、Y同周期,基态Z原于电子分属7个能级,且各能级均为全充满。
(1)X基态原子的价电子排布式是。
(2)WX2中W原子的杂化轨道地 类型是 ;WX2分子的立体构性为。
(3)WX2属于(填“极性”或“非极性”“)分子;若X2Y2的结构简式为Y—X—X—Y,1molX2Y2含有的 键数目为NA。
键数目为NA。
(4)X与Z所形成的化合物晶体的晶胞如下图所示,X的配位数是;该晶体的化学式为。
【选修5:有机化学基础】
已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为C9H10O2,试回答下列有关问题。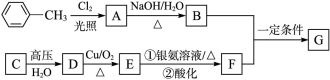
(1)G的名称为。
(2)指出下列反应的反应类型:A转化为B:;C转化为D:。
(3)写出下列反应的化学方程式:
G与足量NaOH溶液反应的化学方程式:。
(4)符合下列条件的G的同分异构体数目为种:
①苯环上有3个取代基,且有两个取代基相同;
②能够与新制的银氨溶液反应产生光亮的银镜。
其中核磁共振氢谱有四种不同化学环境的氢的所有物质的结构简式为、。
【选修3:物质结构与性质】
(1)亚铜离子(Cu+)基态时的价电子排布式表示为。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为(用元素符号表示)。
(3)Cu晶体的堆积方式是(填堆积方式名称),其配位数为;往Cu的硫酸盐溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是_____
| A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.在[Cu(NH3)4 ]2+中Cu2+给出孤对电子,NH3提供空轨道 |
| C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素 |
| D.SO42-与PO43-互为等电子体,空间构型均为正四面体 |
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为。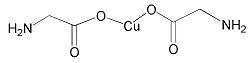
(5)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如下图所示。则该化合物的化学式为。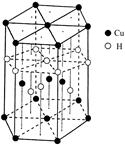
【选修2:化学与技术】
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下: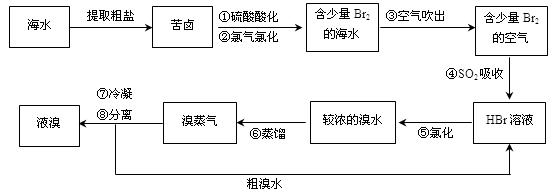
(1)步骤④的离子反应方程式为。
(2)溴微溶于水,步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,它们的相对密度相差较大。分离出液溴的实验室方法为。
(3)步骤⑥如果在实验室中进行,需用到的玻璃仪器有。
(4)工业生产不直接蒸馏含溴的海水得到液溴,而要经过“空气吹出、SO2吸收、氯化”,原因是。
(5)苦卤水还可以用于制取金属镁,用化学方程式表示从苦卤水制取金属镁的反应原理。