已知:①1 g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,②中和热为57.3 kJ·mol-1,③C(石墨s)=C(金刚石s) ΔH=+1.90 kJ·mol-1,下列说法正确的是 ( )。
| A.氢气的燃烧热为241.8 kJ·mol-1 |
| B.氢气燃烧的热化学方程式:2H2+O2=2H2O ΔH=-483.6 kJ·mol-1 |
| C.盐酸和氨水混合的热化学方程式: H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.由③可知金刚石不及石墨稳定 |
下列离子方程式中,书写正确的是
| A.铁和稀硝酸反应:Fe + 2H+ = H 2↑+ Fe 2+ |
| B.向AlCl3溶液中加入过量的氨水反应:Al3+ + 3NH3·H2O = Al(OH)3↓+3NH4+ |
| C.硫酸铜溶液与氢氧化钡溶液反应Ba2++SO42-=BaSO4↓ |
| D.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O |
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是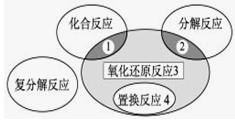
A.2H2+O2点燃2H2O
B .2NaHCO3
.2NaHCO3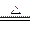 Na2CO3+H2O +CO2↑
Na2CO3+H2O +CO2↑
C.Zn +H2SO4 = ZnSO4 + H2↑
D.CuO+CO 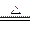 Cu + CO2
Cu + CO2
只用一种试剂,可区别Na2SO4、AlCl3、NH4Cl、MgSO4四种溶液,这种试剂是
| A.HCl | B.BaCl2 | C.AgNO3 | D.NaOH |
下列实验操作或装置正确的是
A.点 燃酒精灯 燃酒精灯 |
B.蒸馏 | C.过滤 | D.稀释浓硫酸 |
将下列各组物质按酸、碱、盐分类顺序排列,其中正确的是
| A.硝酸烧碱硫酸钡 | B.硫酸纯碱胆矾 |
| C.醋酸水玻璃碳酸钙 | D.盐酸熟石灰苛性钠 |