氢氧化钠是一种用途十分广泛的化工原料。工业上主要通过电解氯化钠饱和溶液的方法获得氢氧化钠,我国的氯碱工业大多数采用离子交换膜电解槽。
(1)离子交换膜电解槽一般采用金属钛作阳极,其原因是__________________________________。
阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是____________________________________。
(2)为使电解氯化钠的速率加快,下列措施可行的是__________。
a.增大阴极碳钢网的面积
b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离
d.提高电解时电源电压
(3)如果将某离子交换膜电解槽的①电解时电压增大到原来的2倍;②电解时的电流强度增大到原来的2倍;③电解时温度从30 ℃提高到60 ℃,则电解速率一定会达到原来的2倍的是________________。
能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
请回答下列问题:
(1)在“图1”中,曲线(填“a”或“b”)表示使用了催化剂;该反应属于(填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是
| A.起始充入的CO为1mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大 |
(3)从反应开始到建立平衡, v(H2)=;该温度下CO(g)+2H2(g) 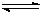 CH3OH(g)的化学平衡常数为。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2)。
(5)科学家常用(填仪器名称)来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol,又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式。
(1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则混合前c(CH3COOH)c(NaOH )(填“<、=或>”,下同);混合后溶液的pH7
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为。
(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和,则V1、V2、V3的大小关系是;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是;室温下,若生成同浓度的NaCl与NH4Cl溶液各1L, 则溶液中离子总数N(NaCl)N(NH4Cl)。(填“<、=或>”)
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。(填字母)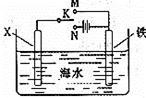
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2CO(g)+O2(g)=2CO2(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为 。
(3)利用右图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处,此时溶液中的阴离子向极(填X或铁)移动。
[化学—选修有机化学基础]
A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图所示,D的相对分子质量与E相差42,请回答下列问题;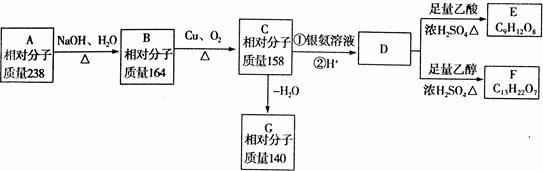
(1)D中含有的官能团是_________;D的分子式为________。
(2)D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3,请写出D的结构简式__________。
(3)写出B生成C的化学方程式___________.
(4)A只含一种官能团,则A的结构简式为___________。
(5)芳香族化合物H与G互为同分异构体,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且H苯环上的一氯代物只有两种,写出符合条件的H的结构简式:______。
[化学—选修物质结构和性质]
下表为部分短周期元素的性质或原子结构,已知A—D的原子序数依次增大。
| 元素编号 |
元素性质或原子结构 |
| A |
A原子所处的周期数、族序数、原子序数均相等 |
| B |
核外电子有6种不同运动状态 |
| C |
最简单氢化物的水溶液呈碱性 |
| D |
基态原子的S轨道电子数等于P轨道电子数 |
请结合表中信息完成下列各小题(答题时用所对应的元素符号)
A:(1)写出C原子的电子排布图____________
(2)A、B、C、D的第一电离能由大到小的顺序为______________
(3)用电离方程式表示C的最简单氢化物的水溶液呈碱性的原因_______________
B:按照共价键理论,分子中每个原子的最外电子层电子数均已饱和。已知ABCD分子可能有三种不同结构,它们的结构可以从其他物质的结构中获得启发。
(4)ABC的结构式是___________。向其中插入一个D原子,若形成配位键(用→表示)则ABCD的结构式为______________分子中C的原子的杂化类型是______________;若无配位键则ABCD的结构式为___________分子中D原子的杂化类型为______________。
(5)BD2的电子式是____________将D原子换成等电子的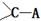 所得ABCD的结构式为________,分子中C原子的杂化类型是______________。
所得ABCD的结构式为________,分子中C原子的杂化类型是______________。
(6)在ABCD的三种可能结构中B原子的杂化类型__________(填“相同”或“不相同”)