某反应体系中的物质有:NF3、HF、NO、HNO3、H2O。请根据要求回答下列问题:
(1)请将NF3、HF之外的反应物与生成物分别填入以下空格内。
NF3 + _______ → HF + ______ + __________
(2)反应过程中,被氧化与被还原的元素的物质的量之比为___________;
(3)配平该反应的化学方程式,并标出电子转移的方向和数目;
(4)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄露,还是易于发现。,你判断该气体泄漏时的现象是_____________________;一旦NF3泄漏,可以用溶液__________(填化学式)喷淋的方法减少污染。
10.4gR2SO4中含0. 1molR2+,则R2SO4的摩尔质量是;R的相对原子质量是。
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是。
(2)方案二:按下图装置进行实验。并回答以下问题:
①实验前应先________________。分液漏斗中应该装___________(填“盐酸”或“稀硫酸盐”)。D装置的作用是_________________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化;
③根据此实验得到的数据,测定结果有较大误差。因为实验装置还存在一个明显缺陷,该缺陷是。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有______________________;
②试验中判断沉淀是否完全的方法是_______________________________________
③若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为_________________(保留一位小数)。
草酸晶体的化学式可表示为H2C2O4·xH2O,为测定x值进行下列实验:
(1)称取W g草酸晶体,配成100.00 mL溶液。
(2)取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为a mol·L-1KMnO4溶液滴定。KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O(未配平)
回答下列问题:
①实验(1)中,为配制准确的草酸溶液,必须使用的仪器有_____________________________;
②实验(2)中,滴定时,KMnO4溶液应盛在___________中(填酸式或碱式滴定管);
③若滴定用的KMnO4溶液因放置而变质,浓度偏低,则根据实验求出的x值______(填偏高、偏低、无影响);
④滴定终点时,锥形瓶内溶液颜色变化是__________________________________;
⑤若滴定终点时,共用去KMnO4溶液V mL,求草酸溶液的物质的量浓度及x的值:
, .
A、B、C三种短周期元素在周期表中相对位置如右图:
| A |
|||
| B |
C |
(1)A与C形成的液态化合物是常见的重要有机溶剂,则
A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱
的顺序是:>>(用化学式表示)。
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g•L-1。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol•L-1Z水溶液pH=13。X、Y、Z有如图转化关系: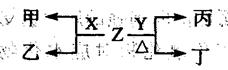
①写出X与Z反应的离子方程式:。
②已知丙能与稀硫酸反应生成能使品红褪色的气体。丁的化学式为,丁的水溶液pH>7的原因是:(用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式。
Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g)△H=?反应情况记录如下表:
pC(g)△H=?反应情况记录如下表:
| 时间/(min) |
n(A)/( mol) |
n(B)/( mol) |
n(C)/( mol) |
| 0 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率V(A)=mol•L-1• min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8 min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min或;
②第6min;
③第8 min。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92kJ则该反应的△H=。
(4)反应在第4 min建立平衡,此温度下该反应的化学平衡常数K=.
Ⅱ.已知:常温下,A酸的溶液pH=a, B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为。
A.大于7 B.等于7C. 小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为
mol•L-1,B溶液中水电离出的氢离子浓度为mol•L-1。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为:
。