铁、铝在生产生活中有广泛的应用。完成下列填空:
(1)铝用作电线是利用了铝的 性;铁用作炊具是利用了铁的 性。
(2)常温下由于浓硫酸能使铁 ,因此浓硫酸可用铁槽车运输。
(3)氢氧化铝既能跟盐酸反应又能跟氢氧化钠溶液反应,由此可知氢氧化铝是 物质。氢氧化铝和盐酸反应的离子方程式为 。
有一瓶澄清的溶液,其中可能含有NH4+、 K+、 Na+、 Mg2+、 Ba2+、 Al3+、
Fe3+、Cl-、Ⅰ-、 NO3-、CO32 -、SO42-中的几种,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性;
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色;
(3)另取出部分溶液,逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生;
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成;。
(5)根据以上实验事实确定①该溶液肯定存在的离子是;②肯定不存在的离子是_____________________________;③还不能确定的离子是________________________,要确定其中的阳离子可利用的方法原理是________________
(1)硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水,其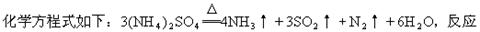
成的氧化产物与还原产物分子个数之比为_______________。
(2)某钠盐A的溶液,实验时有以下一现象:(1)加入Ba(NO3)2溶液时出现白色沉淀,(2)加入Na2CO3,有气泡产生,由此可判断出该钠盐A为___________(化学式),写出有关离子方程式_____________________________,____________________________________。
在酸性条件下:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原成Br2;
②KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原成I2。
(1)上述反应所涉及到的粒子氧化性最强的是(填离子符号);
(2)写出一个能证明氧化性Br2>I2的离子方程式;
(3)向含有KI、H2SO4的溶液中加入KBrO3溶液,若氧化产物、还原产物只有I2和Br2,写出反应的化学方程式,并标明电子转移方向和数目。
_______________________________________________________;
其中被氧化的元素是_________,要得到1mol还原产物转移电子数目为____________。
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+=== 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O ="==" TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________________________________________________________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在____________________范围。
(3)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________________________________(只要求写出一项)。
(4)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| |
TiCl4 |
SiCl4 |
| 熔点/℃ |
-25.0 |
-68.8 |
| 沸点/℃ |
136.4 |
57.6 |
下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题: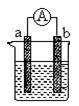
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:
。
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置(填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请指出正、负极。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。
现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用碱性溶液为电解液;则氢气应通入极(填a或b,下同),电子从极流出。a极发生电极反应式为:_____________________________。